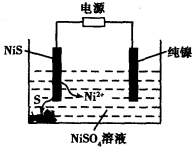
题目内容
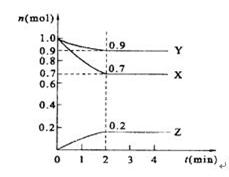
(7分)(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则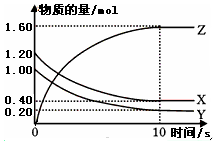
①此反应的化学方程式为________________;
②0~10s内,用Z表示的化学反应速率为________________;
③X的转化率为________________;
(2)恒温恒容时,某密闭容器中发生反应:C(s)+CO2(g) 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
①C(s)的浓度不再改变 ②CO2的体积分数不再改变
③气体的质量不再改变 ④气体的密度不再改变
⑤单位时间内消耗1molCO2,同时生成2molCO
⑥n(CO2):n(CO)=1:2 ⑦v正(CO2)=2v逆(CO)
(1)①X(g)+Y(g) 2Z(g) (2分,不标状态也得分,“==”连接-1分)。
2Z(g) (2分,不标状态也得分,“==”连接-1分)。
②0.08mol/(L·s) (1分) ③66.7%或66.67% (2分) (2)②③④(2分)
解析试题分析:(1)①从图像中可以看出:(Ⅰ)X、Y两种物质的物质的量随时间变少,是反应物,Z的物质的量随时间变多,是生成物;(Ⅱ) 当反应进行到10秒后,X、Y、Z三种物质同时存在,说明这个反应是一个可逆反应;(Ⅲ) X、Y、Z三种物质物质的量的变化之比与化学方程式的化学计量系数之比相等,X的物质的量在10秒内变化了0.8mol,Y的物质的量在10秒内变化了0.8mol,Z的物质的量在10秒内变化了1.6mol,得到X(g)+Y(g) 2Z(g);
2Z(g);
②0~10s内,Z的物质量的变化为1.6mol,浓度的变化为1.6mol/2L="0.8" mol/L, Z的化学反应速率为0.8 mol/L/10s="0.08" mol/(L·s);
③X的转化率=0.8mol/1.2mol=66.7%。
(2)判断一个可逆反应是否达到化学平衡状态,可以从两个方面来考虑:(Ⅰ) v正=v逆>0;(Ⅱ) 混合物各成分浓度不变(注意固体的浓度时常数)。只要符合其一则达到平衡状态。②③④体现了混合物各成分浓度不变;⑤单位时间内消耗1molCO2,同时生成2molCO只说明了正反应速率,与逆反应的反应速率关系无法判断,不能判断是否达到化学平衡状态,错误;⑥中n(CO2)于n(CO)的关系不能判断各成分的浓度是否不变,不能判断是否达到化学平衡状态;⑦中2v正(CO2)=v逆(CO)才能说明v正=v逆,错误。
考点:(1)考查化学反应速率的基本应用。(2)考查可逆反应达到化学平衡状态的判断,尤其是一些容易忽略的问题,如密度、压强等不变时是否能够判断反应达到平衡状态。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案(12 分)T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g) 2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
试回答下列问题:
(1)T℃时,N2的转化率为:___________,该反应的平衡常数K=___________。
(2)T℃时,下列能证明该反应已经建立平衡状态的是:__________________。
| A.体系总压强不再改变 |
| B.混合气体颜色不再改变 |
| C.H2的质量百分含量不再改变 |
| D.c(N2)与c(NH3)的比值不再改变 |
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正 ___ v逆。
(12分).
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为_______________。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为_______。平衡时A 的转化率为_____.
(3) ①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=_______mol,n(A)=_______mol。
②下表为反应物A浓度与反应时间的数据,计算a= _______________
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是_________________,由此规律推出反应在12h时反应物的浓度c(A)为_______mol·L-1
(14分)短周期主族元素A、B、C、D、E原子序数依次增大 , A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E ?H=+a kJ/mol;
② 2A→A-A ?H=-b kJ/mol;
③ E+A→A-E ?H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5 mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 |  3 3 |
v (A2)= 。
② 计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
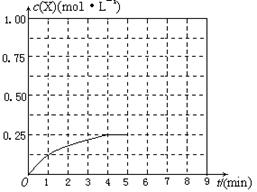
⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
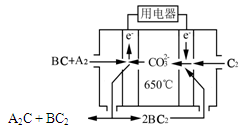
(15分)已知2A(g)+B(g)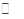 2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”、“=”或“<”)。
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A. 4 mol A和2 mol B B. 4 mol A、2 mol B和2 mol C
C. 4 mol A和4 mol B D. 6 mol A和4 mol B
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A. 及时分离出C气体 B. 适当升高温度
C. 增大B的浓度 D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”、“=”或“<”),理由是_ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使之反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”、“变大”、“变小”或“无法确定”)。

 ,得到如下两组数据:
,得到如下两组数据:
 ____________
____________ (填“<”,“>”,“=”)。
(填“<”,“>”,“=”)。

 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。
mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。 =4时,CO2的转化率随时间的变化关系如图1所示.
=4时,CO2的转化率随时间的变化关系如图1所示.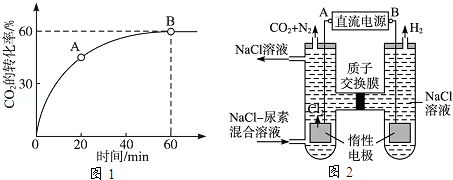
 Ni(CO)4(g)
Ni(CO)4(g)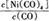 减小,则?H 0(填“>”或“<”)。
减小,则?H 0(填“>”或“<”)。
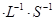 。
。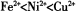 )
)