��Ŀ����
ij�¶�ʱ����2 L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯��������ͼ��ʾ��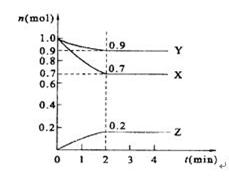
��1����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ ��
��3���ﵽƽ����X��Ũ���� ��
��4������Ӧ���е��� min���÷�Ӧ�ﵽƽ�⡣��Ӧ�ﵽƽ������д�ʩ�ܼӿ컯ѧ��Ӧ���ʵ��� ��
A������Ӧ���Ũ�� B�������¶� C��ʹ��������
��1��3X+Y 2Z
2Z
��2��0��05mol/(l��min�� ��3��0��35mol/l�� ��4��2 ABC
���������������1������X��Y�ڷ�Ӧ�в��ϱ����ģ�Z�������ӡ�Ӱ��X��Y�Ƿ�Ӧ�Z�����������ͬ��ʱ���ڣ��ڷ�Ӧ��X��Y��Z�仯�����ʵ����ı�Ϊ0��1��03��0��2�������ڷ�Ӧ�иı�����ʵ����ıȾ��Ƿ���ʽ������ǰ�ߵļ������ıȡ�����2min��������ʵ����ʵ������������仯�����Ը÷�ӦΪ���淴Ӧ����˷�Ӧ�ķ���ʽΪ��3X+Y 2Z����2��V(Z)="��c�¦�t=" (0��2mol��2L)��2min =0��05 mol/(l��min)��(3���ﵽƽ����X��Ũ����0��7mol��2L=0��35mol/l����4����ͼ����Կ���������Ӧ���е���2min�÷�Ӧ�ﵽƽ�⡣�ܼӿ컯ѧ��Ӧ���ʵĴ�ʩ������Ӧ���Ũ�ȣ������¶ȣ�ʹ�������������ѡ��ΪA B C��
2Z����2��V(Z)="��c�¦�t=" (0��2mol��2L)��2min =0��05 mol/(l��min)��(3���ﵽƽ����X��Ũ����0��7mol��2L=0��35mol/l����4����ͼ����Կ���������Ӧ���е���2min�÷�Ӧ�ﵽƽ�⡣�ܼӿ컯ѧ��Ӧ���ʵĴ�ʩ������Ӧ���Ũ�ȣ������¶ȣ�ʹ�������������ѡ��ΪA B C��
���㣺���黯ѧ����ʽ����д��Ӱ�컯ѧ��Ӧ���ʵ����ء���ѧ��Ӧ���ʵļ����֪ʶ��

��ҵ������Ĺ��������÷�Ӧ2SO2(g)��O2(g) 2SO3(g)+Q (Q��0)����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
2SO3(g)+Q (Q��0)����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
��1��д���ÿ��淴Ӧ�Ļ�ѧƽ�ⳣ������ʽ ��
��2��һ�������£���һ���������ܱ������г���2molSO2��1molO2������Ӧ������˵���У���ȷ���� (����)��
a������Ӧ���ʦ���(O2)=2����(SO3)�������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬
b�������¶Ⱥ�����������䣬����2 mol N2����ѧ��Ӧ���ʼӿ�
c��ƽ����ƶ�����ѹ�����壬ƽ��ʱSO2��O2�İٷֺ�����С��SO3�İٷֺ�������
d��ƽ��������¶ȣ�ƽ�ⳣ��K����
��һ������SO2(g)��O2(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ�õ����±��е��������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | t |
��3��ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱ����(SO2)��ʾ�ķ�Ӧ����Ϊ ��
T1 T2 (ѡ���������������=��)�������� ��β��SO2��NaOH��Һ���պ������Na2SO3�����г�����0.1mol/LNa2SO3��Һ��ʵ��ⶨ��pHԼΪ8������������⣺
��4������Һ��c(Na+)�� c(OH��)֮��Ϊ ��
����Һ��c(OH��)= c(H+)+ + ������Һ����������Ũ�ȱ�ʾ����
��5������ú������ʵ������ʵ����и���Һ�ֱ�������SO2���������������ɶൽ�ٵ�˳���� (�ñ������)
A��Na2SO3 B��Ba(NO3)2 C��Na2S D������KMnO4
 2CO(g)��������������˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����________________��
2CO(g)��������������˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����________________��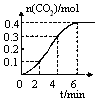
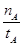 mol��L��1��min��1
mol��L��1��min��1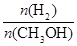 ����
���� CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��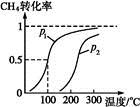
 ��
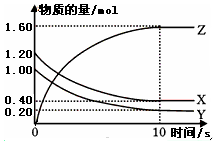
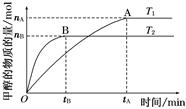
��  C(g)��D(g)�����е������仯��ͼ��ʾ���ش��������⡣
C(g)��D(g)�����е������仯��ͼ��ʾ���ش��������⡣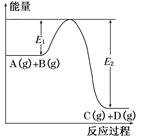
 2C(g)����H<0����Ӧ��ƽ�����ƽ�ⳣ��ΪK����ʱA��ת����Ϊx��
2C(g)����H<0����Ӧ��ƽ�����ƽ�ⳣ��ΪK����ʱA��ת����Ϊx��