题目内容
(17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时,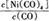 减小,则?H 0(填“>”或“<”)。
减小,则?H 0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol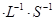 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: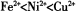 )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。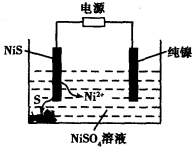
(1)①<;②bd;不变;0.8mol﹒L—1﹒S—1。③增大CO的浓度或增大压强。(2)cd;
(3) 正极;NiS—2e- Ni2++S。
Ni2++S。
解析试题分析:(1)①对于反应:Ni(s)+4CO(g) Ni(CO)4(g),当温度升高时,
Ni(CO)4(g),当温度升高时,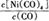 减小,说明平衡逆向移动,升高温度平衡向吸热反应方向移动,则该反应的逆向吸热,正向为放热反应,?H<0;②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,a.随着反应的进行,容器内气体的质量增大,物质的量减小,等压条件下容器体积减小,密度逐渐增大,达平衡时密度不变,与图像不符,错误;b.随着反应的减小,反应物的浓度逐渐减小,正反应速率逐渐减小,达平衡时正反应速率不变,与图像符合,正确;c.?H不随反应的进行而变化,不能作为平衡标志,错误;d.CO的转化率随反应的进行不断增大,达平衡时CO的转化率不变,与图像相符,正确,选bd;若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,影响平衡常数的外界因素为温度,温度不变,平衡常数不变;根据公式v=△n/V△t将题给数据代入计算得v(Ni(CO)4)=0.2mol﹒L—1﹒S—1,则0—3s内的平均反应速率v(CO)=0.8mol﹒L—1﹒S—1。③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为增大CO的浓度或增大压强。(2)迁移教材知识铜的电解精炼作答。以NiSO4溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼, a.电解过程中,电能转化为化学能,错误;b.粗镍作阳极,发生氧化反应,错误;c.精炼过程中比镍活泼的金属Fe、Zn以离子形式进入电解质溶液,活泼性比镍弱的金属Cu、Pt、Au进入阳极泥,正确;d.粗镍精炼时通过的电量与阴极析出镍的质量成正比,正确,选cd;(3) 根据题意知,电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,硫元素的化合价由—2价升高为0价,发生氧化反应,作电解池的阳极,与电源的正极相接。阳极的电极反应式为NiS—2e-
减小,说明平衡逆向移动,升高温度平衡向吸热反应方向移动,则该反应的逆向吸热,正向为放热反应,?H<0;②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,a.随着反应的进行,容器内气体的质量增大,物质的量减小,等压条件下容器体积减小,密度逐渐增大,达平衡时密度不变,与图像不符,错误;b.随着反应的减小,反应物的浓度逐渐减小,正反应速率逐渐减小,达平衡时正反应速率不变,与图像符合,正确;c.?H不随反应的进行而变化,不能作为平衡标志,错误;d.CO的转化率随反应的进行不断增大,达平衡时CO的转化率不变,与图像相符,正确,选bd;若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,影响平衡常数的外界因素为温度,温度不变,平衡常数不变;根据公式v=△n/V△t将题给数据代入计算得v(Ni(CO)4)=0.2mol﹒L—1﹒S—1,则0—3s内的平均反应速率v(CO)=0.8mol﹒L—1﹒S—1。③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为增大CO的浓度或增大压强。(2)迁移教材知识铜的电解精炼作答。以NiSO4溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼, a.电解过程中,电能转化为化学能,错误;b.粗镍作阳极,发生氧化反应,错误;c.精炼过程中比镍活泼的金属Fe、Zn以离子形式进入电解质溶液,活泼性比镍弱的金属Cu、Pt、Au进入阳极泥,正确;d.粗镍精炼时通过的电量与阴极析出镍的质量成正比,正确,选cd;(3) 根据题意知,电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,硫元素的化合价由—2价升高为0价,发生氧化反应,作电解池的阳极,与电源的正极相接。阳极的电极反应式为NiS—2e- Ni2++S。
Ni2++S。
考点:考查化学反应速率、化学平衡的影响因素及计算,电解原理的应用及电极反应式的书写。

(9分)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(2)列式计算15 ℃时该反应的平衡常数_________________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施有_________(要求写出两条)。
(15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式__________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(选填“增大”、“减小”、“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 ;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 。
(10分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=__________。
(2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。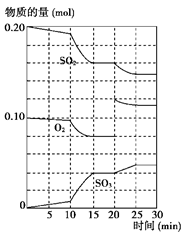
(4)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ _(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加SO3的物质的量 |
 CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。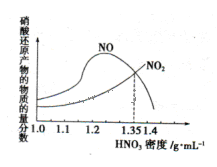
 的硝酸反应的化学方程式:______________________.
的硝酸反应的化学方程式:______________________.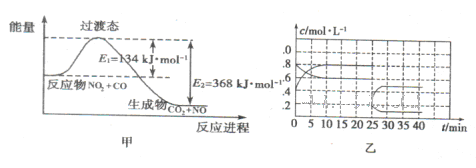
 N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
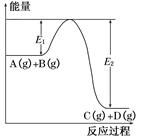
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。