题目内容
【题目】(1)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
①以甲烷、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________________________。
②将质量相等的铁棒和石墨棒分别插入CuCl2溶液中,铁棒接甲烷燃料电池负极,石墨棒接该电池正极,一段时间后测得铁棒比石墨棒增加了6.4克。写出铁棒电极上发生的电极反应式________;则理论上消耗CH4的体积在标准状况下为_____。
(2)如图所示的实验装置中,丙为用碘化钾溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹;丁为直流电源,x、y为电源的两极;G为电流计;A、B、C、D四个电极均为石墨电极。若在两试管中充满H2SO4溶液后倒立于H2SO4溶液的水槽中,闭合K2,断开K1。
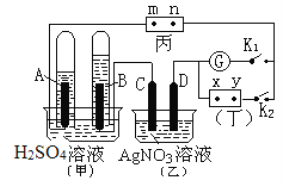
①丙电解时反应的离子方程式为______________。
②继续电解一段时间后,甲池中A、B极均部分被气体包围,此时断开K2,闭合K1,电流计G指针发生偏转,则B极的电极反应式为__________________,C极的电极反应为__________________。
【答案】 CH4-8e-+10OH-=CO32-+7H2O Cu2++2e-===Cu 0.56L 2I-+2H2O![]() I2+H2↑+2OH- O2+4e-+4H+=2H2O 4OH--4e-=O2↑+2H2O
I2+H2↑+2OH- O2+4e-+4H+=2H2O 4OH--4e-=O2↑+2H2O
【解析】(1)①总反应为甲烷和氧气反应生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾,所以总方程式为:CH4 + 2O2 + 2OH- = CO32- + 3H2O。正极是氧气得电子:O2 + 2H2O + 4e- = 4OH-,总反应减去正极反应(将正极反应扩大2倍,以消去氧气),得到负极反应为:CH4-8e-+10OH-=CO32-+7H2O。
②将质量相等的铁棒和石墨棒分别插入CuCl2溶液中,铁棒接甲烷燃料电池负极,石墨棒接该电池正极,则铁棒为电解的阴极,反应为:Cu2+ + 2e- = Cu;石墨棒为电解的阳极,反应为:2Cl- - 2e- = Cl2↑。一段时间后测得铁棒比石墨棒增加了6.4克,这6.4g是生成的单质铜(0.1mol),则根据电极反应得到转移电子为0.2mol,1个甲烷生成碳酸根失去8个电子,所以参加反应的甲烷为0.025mol,即0.56L。
(2)①丙是碘化钾溶液,电解时阴阳两极分别是水电离的氢离子和碘化钾电离的碘离子反应,所以总方程式为2I-+2H2O![]() I2+H2↑+2OH-
I2+H2↑+2OH-
②闭合K2,断开K1时,是用直流电源对甲乙丙进行串联电解。A中得到氢气,B中得到氧气(因为A中气体的体积大约是B的2倍),所以A为电解的阴极,B为电解的阳极,进而得到直流电源x为正极,y为负极。断开K2,闭合K1,电流计G指针发生偏转,说明形成原电池。由题意只可能是甲中形成氢气氧气燃料电池,对乙丙进行电解。所以B电极为原电池的正极,反应为氧气在酸性条件下得电子,方程式为O2+4e-+4H+=2H2O。因为B为正极,所以C为电解的阳极,注意此时c电极表面应该有刚才断开K2,闭合K1时,进行电解得到的单质银。所以此时c电极的反应为Ag-e- = Ag+。

 阅读快车系列答案
阅读快车系列答案【题目】在1.0L密闭容器中放入0.10mol A(g),在一定温度进行如下反应:A(g)═B(g)+C(g)△H=+85.1kJmol﹣1反应时间(t)与容器内气体总压强(p)的数据见表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为(写出两项措施).
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为 . 平衡时A的转化率为 , 列式并计算反应的平衡常数K .
(3)由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=mol,n(A)=mol.