题目内容
【题目】根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,
(1)画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中) , 供选用的电解质溶液有:稀硫酸、硫酸铜溶液、三氯化铁溶液.
供选用的电极材料有:锌片、铜片、铁片、石墨.
(2)写出电极反应式. 电极材料及电极反应式:
负极材料: ,
电极反应式:
正极材料: ,
电极反应式:
电解质溶液:
【答案】
(1)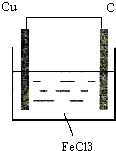
(2)Cu;Cu﹣2e﹣=Cu2+;碳棒;2Fe3++2e﹣=2Fe2+;氯化铁溶液
【解析】解:(1)由方程式Cu+2FeCl3=CuCl2+2FeCl2可知,Cu被氧化,为原电池的负极,负极反应为Cu﹣2e﹣=Cu2+ , 正极Fe3+被还原,电极方程式为2Fe3++2e﹣=2Fe2+ , 正极可为碳棒,电解质溶液为氯化铁, 则原电池装置图可设计为 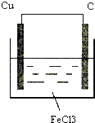 ,
,
所以答案是:(1) 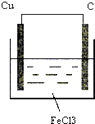 ;(2)Cu;Cu﹣2e﹣=Cu2+;碳棒;2Fe3++2e﹣=2Fe2+;氯化铁溶液.
;(2)Cu;Cu﹣2e﹣=Cu2+;碳棒;2Fe3++2e﹣=2Fe2+;氯化铁溶液.

练习册系列答案
相关题目
【题目】如表是周期表中的一部分,根据A﹣K在周期表中的位置,用元素符号或化学式回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H | ||||
4 | J | K |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 氧化性最强的单质是 , 还原性最强的单质是 .
(2)最高价氧化物的水化物碱性最强的是 , 酸性最强的是 , 呈两性的是 .
(3)A分别与D,E,F,G,H形成的化合物中,最稳定的 ,
(4)在这些元素中(除I外),原子半径最大的是 , 原子半径最小的是
(5)D和K组成化合物的电子式 ,
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式: .