题目内容
(1)已知1g碳粉在氧气中完全燃烧放出的热量是32.8kJ,试写出相关的热化学方程式: .
(2)在25℃、101kPa下,1g氢气燃烧生成液态水时放热143kJ.则表示氢气燃烧热的热化学方程式为 .
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,该反应的热化学方程式 .
(4)已知:将水蒸气通过红热的炭即产生水煤气.C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ?mol-1,△S=+133.7J?mol-1?K-1则该反应在低温下能否自发 (填:能或否).
(5)已知:O2(g)═O2+(g)+e-△H1=+1175.7kJ?mol-1
PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ?mol-1
O2PtF6(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ?mol-1
则反应O2(g)+PtF6(g)═O2PtF6(s)的△H= kJ?mol-1.
(2)在25℃、101kPa下,1g氢气燃烧生成液态水时放热143kJ.则表示氢气燃烧热的热化学方程式为
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,该反应的热化学方程式
(4)已知:将水蒸气通过红热的炭即产生水煤气.C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ?mol-1,△S=+133.7J?mol-1?K-1则该反应在低温下能否自发
(5)已知:O2(g)═O2+(g)+e-△H1=+1175.7kJ?mol-1
PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ?mol-1
O2PtF6(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ?mol-1
则反应O2(g)+PtF6(g)═O2PtF6(s)的△H=
考点:热化学方程式,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:(1)根据热化学方程式的书写方法可知,应注意化学计量数与反应热的对应关系及各物质的聚集状态来解答.
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(3)根据热化学方程式的书写方法;
(4)根据反应能否自发进行的判据:△H-T△S<0,反应自发进行,代入数据来计算;
(5)根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(3)根据热化学方程式的书写方法;
(4)根据反应能否自发进行的判据:△H-T△S<0,反应自发进行,代入数据来计算;
(5)根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
解答:
解:(1)1g碳粉在氧气中完全燃烧放出的热量是32.8kJ,12g碳粉在氧气中完全燃烧并放出393.6kJ热量,则热化学方程式为:C(s)+O2(g)=CO2( g)△H=-393.6 kJ/mol;
故答案为:C(s)+O2(g)=CO2( g)△H=-393.6 kJ/mol;
(2)在25℃、101kPa下,1g氢气燃烧生成液态水时放热143kJ,1mol氢气完全燃烧燃烧生成液态水时放热286kJ,所以氢气燃烧热的热化学方程式为H2(g)+
O2(g)=H2O(l)△H=-286 kJ/mol,
故答案为:H2(g)+
O2(g)=H2O(l)△H=-286 kJ/mol;
(3)(3)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,所以有10NA个电子转移时,放出1300kJ的热量,则热化学方程式为:C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ?mol-1,
故答案为:C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ?mol-1;
(4))△H-T△S=131.3KJ/mol-T×133.7×0.001KJ?mol-1?K-1,在低温下,该值一定是大于0的,所以不能在低温下自发进行;
故答案为:否;
(5)①O2(g)═O2+(g)+e-△H1=+1175.7kJ?mol-1
②PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ?mol-1
③O2PtF6(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ?mol-1
根据盖斯定律,由①+②-③得:O2(g)+PtF6(g)═O2PtF6(s)△H=-77.6 kJ/mol;
故答案为:-77.6.
故答案为:C(s)+O2(g)=CO2( g)△H=-393.6 kJ/mol;
(2)在25℃、101kPa下,1g氢气燃烧生成液态水时放热143kJ,1mol氢气完全燃烧燃烧生成液态水时放热286kJ,所以氢气燃烧热的热化学方程式为H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(3)(3)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,所以有10NA个电子转移时,放出1300kJ的热量,则热化学方程式为:C2H2(g)+
| 5 |
| 2 |
故答案为:C2H2(g)+
| 5 |
| 2 |
(4))△H-T△S=131.3KJ/mol-T×133.7×0.001KJ?mol-1?K-1,在低温下,该值一定是大于0的,所以不能在低温下自发进行;
故答案为:否;
(5)①O2(g)═O2+(g)+e-△H1=+1175.7kJ?mol-1
②PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ?mol-1
③O2PtF6(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ?mol-1
根据盖斯定律,由①+②-③得:O2(g)+PtF6(g)═O2PtF6(s)△H=-77.6 kJ/mol;
故答案为:-77.6.
点评:本题考查热化学方程式的书写、盖斯定律、反应热的计算等,难度中等,注意盖斯定律的理解与运用.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列实验方法或除杂方法正确的是( )
| A、钠也可以保存在CCl4中 |
| B、钠着火时可以砂土来扑灭 |
| C、除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤 |
| D、除去Al粉中混有的Mg:加足量NaOH溶液后,过滤、洗涤 |
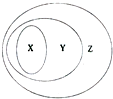 如图表示了x、y、z事物间的从属关系,下列选项中不符合图中事物间从属关系的是( )
如图表示了x、y、z事物间的从属关系,下列选项中不符合图中事物间从属关系的是( )