题目内容
13. 在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分,当左边充入1molN2,右边充入8gCO和CO2的混合气体,隔板处于如图所示位置(两侧温度相同),则混合气体中CO和CO2的总物质的量为0.25mol,其中CO和CO2的分子数之比为3:1.
在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分,当左边充入1molN2,右边充入8gCO和CO2的混合气体,隔板处于如图所示位置(两侧温度相同),则混合气体中CO和CO2的总物质的量为0.25mol,其中CO和CO2的分子数之比为3:1.
分析 相同条件下,气体的物质的量与体积成正比,根据图示气体体积计算CO和二氧化碳的总物质的量;分别设出一氧化碳和二氧化碳的物质的量,然后根据质量、物质的量列式计算出CO和CO2的物质的量之比,从而得出其分子数之比.
解答 解:隔板可以自由滑动,则最终隔板两边的气体体积与气体的物质的量成正比,
已知氮气的物质的量为1mol,则CO和CO2的物质的量为:1mol×$\frac{1}{4}$=0.25mol;
设混合气体中含有CO为xmol、含有ymol二氧化碳,
则:x+y=0.25,
28x+44y=8g,
联立解得:x=0.1875mol、y=0.0625mol,
根据N=nNA可知,气体的分子数与其物质的量成正比,
则混合气体中CO和CO2的分子数之比为:0.1875mol:0.0625mol=3:1,
故答案为:0.25;3:1.
点评 本题考查了阿伏伽德罗定律及其推论的应用,题目难度中等,注意掌握阿伏伽德罗定律及其推论,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
16.下列离子方程式与实验事实相符且正确的是( )
| A. | 向AgI浊液中滴入NaCl溶液,产生大量白色沉淀:AgI(s)+Cl-(aq)=AgCl(s)+I-(aq) | |
| B. | 用氨水除去铝片表面的氧化膜:Al2O3+2NH3•H2O=2AlO2-+2NH4++H2O | |
| C. | 用铁氰化钾溶液检验Fe2+:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ | |
| D. | 向酸性KMnO4溶液中滴入过氧化氢产生无色气泡:2MnO4-+9H2O2+6H+=2Mn2++7O2↑+12H2O |
17.下列事实一定能说明HF是弱酸的是( )
| A. | 常温下NaF溶液的pH大于7 | |
| B. | HF能与Na2CO3溶液反应,产生CO2气体 | |
| C. | 1mol/L的HF水溶液能使紫色石蕊试液变红 | |
| D. | 用HF溶液做导电性实验,灯泡很暗 |
1.进行化学实验必须注意安全,下列几种处理事故的方法正确的是( )
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干即可;
②酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭;
③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛;
④镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火;
⑤实验时不慎打破水银温度计,立即用硫粉处理.
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干即可;
②酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭;
③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛;
④镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火;
⑤实验时不慎打破水银温度计,立即用硫粉处理.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①③④ |
8.分类法在化学学科的发展中起到了非常重要的作用.下列分类标准不合理的是( )
①根据组成元素将氧化物分成酸性氧化物和碱性氧化物
②根据在水溶液里是否完全电离将电解质分为强电解质和弱电解质
③根据是否有丁达尔现象将分散系分为溶液、胶体和浊液
④根据水溶液是否能导电将化合物分为电解质和非电解质.
①根据组成元素将氧化物分成酸性氧化物和碱性氧化物
②根据在水溶液里是否完全电离将电解质分为强电解质和弱电解质
③根据是否有丁达尔现象将分散系分为溶液、胶体和浊液
④根据水溶液是否能导电将化合物分为电解质和非电解质.
| A. | .②③ | B. | .②④ | C. | ①②③ | D. | .①③④ |
5.现有bXn-和aYm+两种离子,它们的电子数相同,则a与下列式子有相等关系的是( )
| A. | b-m-n | B. | b+m-n | C. | b-m+n | D. | b+m+n |
2.下列说法不正确的是( )
| A. | 天然油脂含酯基属于酯类物质 | B. | 石油裂化和裂解都可制得烯烃 | ||
| C. | 酚醛树脂是酚与醛的缩聚产物 | D. | 麦芽糖和蔗糖的水解产物相同 |
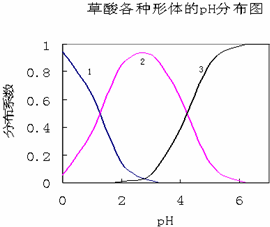 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示: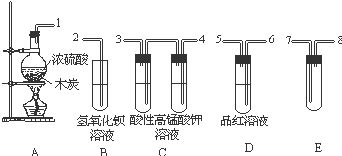 浓H2SO4与炭反应,产物成分可用如图装置来确认:
浓H2SO4与炭反应,产物成分可用如图装置来确认: