题目内容
【题目】研究氮氧化物的反应机理,对于消除环境污染有重要意义。
(1)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
i:2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
ii:N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
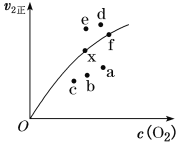
②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
(2)100℃时,若将0.100 mol N2O4气体放入1 L密闭容器中,发生反应N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:
2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:

①在0~40 s时段,化学反应速率v(NO2)为______ mol·L-1·s-1
②下列能说明该反应达到平衡状态的是________(填选项字母)。
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是_________(填选项字母)。
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2
④100℃时,若将9.2 g NO2和N2O4气体放入1 L密闭容器中,发生反应N2O4(g)![]() 2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
⑤上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当
【答案】![]() a 0.0025 BD BC < 3.9×106
a 0.0025 BD BC < 3.9×106
【解析】
(1)①由反应达平衡状态,所以![]() ,所以
,所以![]() ,
, ![]() ,据此分析;
,据此分析;
②![]() 的速率随温度的升高而减小,因为决定该反应速率的是反应②,故升高到温度时v2正减小,且平衡逆向移动,氧气的浓度增大;
的速率随温度的升高而减小,因为决定该反应速率的是反应②,故升高到温度时v2正减小,且平衡逆向移动,氧气的浓度增大;
(2)①![]() ,由反应速率之比等于化学计量数之比,则
,由反应速率之比等于化学计量数之比,则![]() ;
;
②平衡状态的判定;
③利用等效平衡思想解决;
④题干中给出的数据算出平均分子量=气体总质量气体总的物质的量=![]() =57.5g/mol,某时刻测得容器内气体的平均相对分子质量为50,说明反应需向体积缩小的方向进行;
=57.5g/mol,某时刻测得容器内气体的平均相对分子质量为50,说明反应需向体积缩小的方向进行;
⑤列三段式解出![]() 的分压,计算即可。
的分压,计算即可。
(1)①![]() ;②
;②![]() ;目标反应
;目标反应![]() ,由反应达平衡状态,所以
,由反应达平衡状态,所以![]() ,所以
,所以![]() ,
, ![]() ,则
,则![]() ,故答案为:
,故答案为:![]() ;
;
②![]() 的速率随温度的升高而减小,因为决定该反应速率的是反应②,故升高到温度时v2正减小,且平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:a;
的速率随温度的升高而减小,因为决定该反应速率的是反应②,故升高到温度时v2正减小,且平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:a;
(2)①由表可知,040s时间内![]() 的浓度由0.10mol/L减小为0.050mol/L,则其反应速率为
的浓度由0.10mol/L减小为0.050mol/L,则其反应速率为![]() ,由反应速率之比等于化学计量数之比,则
,由反应速率之比等于化学计量数之比,则![]() 的反应速率为
的反应速率为![]() ,故答案为:0.0025;
,故答案为:0.0025;
②A.未体现正逆反应速率的关系,A错误;
B.体系的颜色不再改变,说明二氧化氮的浓度不变,B正确;
C.无论是否反应,体系的混合气体的总质量不变,体积不变,故密度不变,C错误;
D.该反应正反应为体积增大的反应,混合气体的压强不再改变,说明气体的物质的量不变,达到平衡状态,D正确;
故答案为:BD;
③A. 充入一定量的![]() ,相当于加压,达新平衡时,则
,相当于加压,达新平衡时,则![]() 的体积分数减小,故A错误;
的体积分数减小,故A错误;
B. 增大容器的容积,减压,平衡向体积增大的方向移动,即正向移动,![]() 的体积分数增大,故B正确;
的体积分数增大,故B正确;
C. 分离出一定量的![]() ,相当于减压,使
,相当于减压,使![]() 的体积分数增大,故C正确;
的体积分数增大,故C正确;
D. 充入一定量的![]() ,总压增大,气体分压不变,不会引起化学平衡的移动,二氧化氮浓度不变,故D错误;
,总压增大,气体分压不变,不会引起化学平衡的移动,二氧化氮浓度不变,故D错误;
故答案为:BC;
④100℃时,将0.100mol![]() 气体放入1L密闭容器中,平衡时,
气体放入1L密闭容器中,平衡时,![]() ,
,![]() ,平均分子量=气体总质量气体总的物质的量=
,平均分子量=气体总质量气体总的物质的量=![]() =57.5g/mol,将9.2g
=57.5g/mol,将9.2g![]() 和
和![]() 气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,说明反应需向体积缩小的方向进行,即
气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,说明反应需向体积缩小的方向进行,即![]() ,故答案为:<;
,故答案为:<;
⑤当N2O4分解10%时,设投入的N2O4为1mol,转化的N2O4为0.1mol,则: ,故此时
,故此时![]() ,则
,则![]() ,故答案为:3.9×106。
,故答案为:3.9×106。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案