题目内容
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是
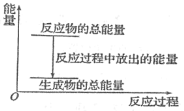
A.反应过程中的能量关系可用上图表示
B.1 mol Zn的能量大于1 mol H2的能量
C.若将其设计为原电池,则其能量转化形式为电能转化为化学能
D.若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
【答案】A
【解析】
A. 该反应为放热反应,反应物的总能量高于生成物的总能量 ,所以其反应过程中的能量关系可用上图表示,A叙述正确;
B. 放热反应中,反应物的总能量高于生成物的总能量,但不能确定1 mol Zn的能量是否大于1 mol H2的能量,B叙述不正确;
C. 若将其设计为原电池,则其能量转化形式为化学能转化为电能,C叙述不正确;
D. 若将其设计为原电池,当有32.5 g Zn(物质的量为0.5mol)溶解时,Zn失去1mol电子,若化学能完全转化为电能,则正极放出的氢气在标准状况下为11.2 L,但是未指明温度和压强,不能确定一定是11.2 L,D说法不正确。
本题选A。

练习册系列答案
相关题目