题目内容
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为____。
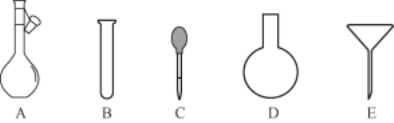
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是___;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的____(填字母代号)。
(3)滴定终点的判定现象是____。
(4)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/LNH4Fe(SO4)2 标准溶液V mL,则TiO2质量分数表达式为____。
(5)下列操作对TiO2质量分数测定结果偏高的是(______)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出
②若在滴定终点读取滴定管刻度时,俯视标准液液面
③若在滴定时滴定前尖嘴部分有气泡,滴定后无气泡
【答案】TiCl4+(2+x)H2O=TiO2·xH2O↓+4HCl 抑制NH4 Fe(SO4)2水解 AC 溶液变成红色,并且在半分钟内不褪色 ![]() 或
或![]() % ①③
% ①③
【解析】
配制盐溶液时,若盐易水解,则在盐溶解于水的过程中,会生成水解产物,从而使溶液变浑浊。所以,应先将盐的晶体溶解在对应的酸中,然后加水稀释至所需的浓度。
(1)TiCl4水解生成TiO2·xH2O的化学方程式为TiCl4+(2+x)H2O=TiO2·xH2O↓+4HCl;
(2)配制NH4Fe(SO4)2标准溶液时,因为盐中的Fe2+、NH4+都易发生水解,生成碱和酸,所以应设法阻止水解反应的发生,即加入一定量H2SO4;配制一定物质的量浓度的溶液,除去使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要使用胶头滴管和容量瓶;答案为:AC;
(3)滴定终点时,NH4Fe(SO4)2溶液稍过量,它能使KSCN溶液变红色,所以判定滴定终点的现象是溶液变成红色,并且在半分钟内不褪色;
(4)滴定分析时,有下列转化:TiO2——Ti3+——Fe3+
TiO2质量分数为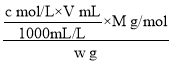 =
=![]() ;
;
(5)①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,则c[NH4Fe(SO4)2]偏小,V偏大,所以对TiO2质量分数测定结果偏高,①正确;
②若在滴定终点读取滴定管刻度时,俯视标准液液面,V偏小,所以对TiO2质量分数测定结果偏低,②错误;
③若在滴定时滴定前尖嘴部分有气泡,滴定后无气泡,则V偏大,所以对TiO2质量分数测定结果偏高,③正确;
由以上分析知,①③符合题意;故选①③。

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/ mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH=7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A. a>9B. 在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C. c1=0.2D. 丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)
【题目】一定条件下,可逆反应2A(g)![]() B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D