题目内容
【题目】铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应, 且有气体、有沉淀产生,则该盐是 ( )
A.Ba(NO3)2B.KClC.Na2SO4D.FeCl3
【答案】A
【解析】
A. 酸性条件硝酸根离子有强氧化性,能和铜反应生成硝酸铜、NO、水,加入钡离子产生硫酸钡沉淀,A项正确;
B. KCl加入溶液,不发生反应,B项错误;
C. Na2SO4加入溶液,不发生反应,C项错误;
D. FeCl3与铜发生氧化还原反应,生成亚铁离子和铜离子,无气体无沉淀,D项错误;
答案选A。

【题目】将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+O2(g)2SO3(g)△H<0.得到如表中的两组数据:
实验编号 | 温度/℃ | 平衡常数/mol﹣1L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
① | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
② | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法不正确的是( )
A.x=1.6,y=0.2,t<6
B.T1、T2的关系:T1>T2
C.K1、K2的关系:K2>K1
D.实验1在前6 min的反应速率v (SO2)=0.2 molL﹣1min﹣1
【题目】甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
(1)已知:①H2(g)+1/2O2(g)![]() H2O(l) ΔH1=-285.8 kJ/mol;
H2O(l) ΔH1=-285.8 kJ/mol;
②CO (g)+1/2O2 (g)![]() CO2 (g) ΔH2=-283kJ/mol
CO2 (g) ΔH2=-283kJ/mol
③CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH3=-764.6 kJ/mol
CO2(g)+2H2O(l) ΔH3=-764.6 kJ/mol
则工业制备甲醇的可逆反应热化学方程式为_______________________________;
(2)恒温恒容条件下,下列描述中能说明上述反应已达平衡状态的是__________。
A.单位时间内生成n mol CO的同时生成2n mol H2 B.ν(H2)正=2ν(CH3OH)逆
C.容器内气体的密度保持不变 D.容器中气体的压强保持不变
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,CO物质的量随时间变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
n(CO)/mol | 1.00 | 0.79 | 0.63 | 0.54 | 0.50 | 0.50 |
则从反应开始到20min时,以ν(H2)=________,该温度下平衡常数K=_______。
(4)加入催化剂后在250 ℃开始反应,CO的平衡转化率与温度、压强的关系如图所示。
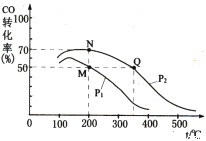
①M、N、Q三点的平衡常数KM、KN、KQ的大小关系为___________________________。
②由M点到N点改变的外界条件是_________。
A、降低温度 B、增大压强
C、改用更好的催化剂 D、通入更多的CO
(5)25℃时以稀硫酸为电解质溶液制成甲醇燃料电池,则负极的电极方程式为_________________________。



