题目内容
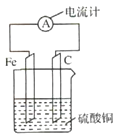
【题目】I.反应Fe+H2S04=FeS04+H2↑的能量变化趋势,如图所示:

(1)该反应为______反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”)。铜片上产生的现象为_____________,该极上发生的电极反应为____________,
II.在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)=3C(g)+nD(g),开始时 A为4mol, B为6 mol, 5min末时测得C的物质的量为3mol,用D表示的化学反应速率![]() (D)为 0.2 mol/(Lmin).
(D)为 0.2 mol/(Lmin).
计算:
(1)5 min末A的物质的量浓度为_________。
(2)前5 min 内用B表示的化学反应速率![]() (B))为__________。
(B))为__________。
(3)化学方程式中n的值为_________。
(4)此反应在四种不同情况下的反应速率分别为:

其中反应速率最快的是________(填编号)。
【答案】 放热 正 产生无色气泡 2H++2e-===H2↑ 1.5 mol·L-1 0.2 mol/(L·min) 2 ①
【解析】分析: I.(1)从能量图可知生成物总能量小于反应物的总能量,为放热反应;(2)该反应中铁是还原剂,作负极,比铁活泼性差的铜应作正极。铜片上,氢离子得到电子,反应式为2H++2e-===H2↑,外电路电子由负极流向正极。
II.(1)根据C的物质的量计算反应的A的物质的量,从而知道为反应的A的物质的量,再利用浓度公式计算;(2)根据C的物质的量计算反应的B的物质的量,根据反应速率公式计算;
(3)根据同一反应中、同一时间段内,各物质的反应速率之比等于计量数之比确定n值;(4)把不同物质的反应速率换算成同一物质的反应速率进行比较。
I. (1)据能量变化图可知该反应是放热反应;故答案为:放热;
(2)该反应中铁是还原剂,作负极,比铁活泼性差的铜应作正极。铜片上,氢离子得到电子,反应式为2H++2e-===H2↑,有气泡产生,外电路电子由负极流向正极。故答案为:正; 产生无色气泡 ;2H++2e-===H2↑。
II. (1) A(g)+2B(g)=3C(g)+nD(g),
反应开始(mol) 4 6 0
反应(mol) 1 2 3
5min末(mol) 3 4 3
c(A)=![]() =
=![]() =1.5mol/L,因此,本题正确答案是: 1.5 mol·L-1;
=1.5mol/L,因此,本题正确答案是: 1.5 mol·L-1;
(2)![]() (B)=
(B)=![]() =
=![]() = 0.2 mol/(L·min),因此,本题正确答案是: 0.2 mol/(L·min);
= 0.2 mol/(L·min),因此,本题正确答案是: 0.2 mol/(L·min);
(3)根据同一反应中、同一时间段内,各物质的反应速率之比等于计量数之比,所以![]() (B):
(B):![]() (D)= 0.2 mol/(L·min): 0.2 mol/(L·min)=2:n,n=2;因此,本题正确答案是:2;
(D)= 0.2 mol/(L·min): 0.2 mol/(L·min)=2:n,n=2;因此,本题正确答案是:2;
(4)把所有速率都换算成A的反应速率;
①![]() (A)= 5mol/(L·min)
(A)= 5mol/(L·min)
②由![]() (B)=6 mol/(L·min)知,
(B)=6 mol/(L·min)知,![]() (A)= 3mol/(L·min)
(A)= 3mol/(L·min)
③由![]() (C)= 4.5 mol/(L·min)知,
(C)= 4.5 mol/(L·min)知,![]() (A)= 1.5mol/(L·min)
(A)= 1.5mol/(L·min)
④由![]() (D =8mol/(L·min)知,
(D =8mol/(L·min)知,![]() (A)= 4mol/(L·min)
(A)= 4mol/(L·min)
故选:①。

 名校课堂系列答案
名校课堂系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |