题目内容
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是______>______>______.
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为______.
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O.
①写出第二步反应的离子方程式______.
②工业生产时需在反应物中加少量Cl-,其作用是______.
③生产中会发生副反应ClO3-+Cl-+H+-Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为
,则起始投料时CH3OH与NaClO3的物质的量之比为______.
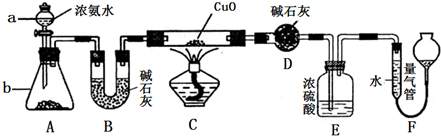
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:
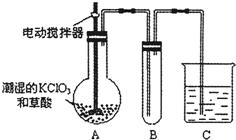
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置______;
②C中应装的试剂为______.C中发生反应的化学方程式为:______.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是______>______>______.
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为______.
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O.
①写出第二步反应的离子方程式______.
②工业生产时需在反应物中加少量Cl-,其作用是______.
③生产中会发生副反应ClO3-+Cl-+H+-Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为
| 3 |
| 73 |
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:

①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置______;
②C中应装的试剂为______.C中发生反应的化学方程式为:______.
(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别为
×5、
×3、
×2×1,所以由大到小的顺序为ClO2>Cl2>Na2FeO4,故答案为:ClO2;Cl2;Na2FeO4;
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子和水反应生成氢氧化铁胶体,胶体具有吸附性是,所以能净水,反应方程式为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
(3)①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式为CH3OH+3Cl2+H2O=6Cl-+CO2+6H+,
故答案为:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②通过分析离子方程式得出,Cl-没有参加反应,作为催化剂,故答案为:催化剂;
③工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,(一般用硫酸酸化)涉及反应的化学方程式为①CH3OH+6NaClO3+3H2SO4→6ClO2+CO2+3Na2SO4+5H2O,生产中会发生副反应②ClO3-+5Cl-+6H+=3Cl2↑+3H2O,生成气体为ClO2、CO2和Cl2,若测得反应后的混合气体中Cl2的体积分数为
,由①可知,如ClO2为60mol,则CO2为10mol,Cl2为3mol,则需要10molCH3OH,(60+1)molNaClO3,则二者体积之比为10:61=1:6.1,
故答案为:1:6.1;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,故答案为:(冰水)冷凝;
②C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为2ClO2+2NaOH═NaClO2+NaClO3+H2O,
故答案为:NaOH溶液;2ClO2+2NaOH═NaClO2+NaClO3+H2O.
| m |
| 67.5 |
| m |
| 166 |
| m |
| 71 |
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子和水反应生成氢氧化铁胶体,胶体具有吸附性是,所以能净水,反应方程式为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
(3)①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式为CH3OH+3Cl2+H2O=6Cl-+CO2+6H+,
故答案为:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②通过分析离子方程式得出,Cl-没有参加反应,作为催化剂,故答案为:催化剂;
③工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,(一般用硫酸酸化)涉及反应的化学方程式为①CH3OH+6NaClO3+3H2SO4→6ClO2+CO2+3Na2SO4+5H2O,生产中会发生副反应②ClO3-+5Cl-+6H+=3Cl2↑+3H2O,生成气体为ClO2、CO2和Cl2,若测得反应后的混合气体中Cl2的体积分数为
| 3 |
| 73 |
故答案为:1:6.1;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,故答案为:(冰水)冷凝;
②C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为2ClO2+2NaOH═NaClO2+NaClO3+H2O,
故答案为:NaOH溶液;2ClO2+2NaOH═NaClO2+NaClO3+H2O.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
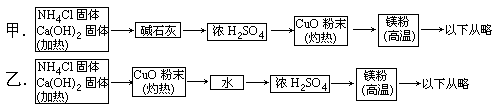
 3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。
3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。