题目内容
 3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。
3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。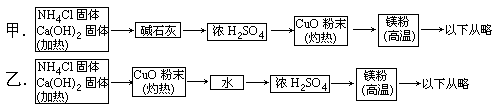
(1)甲、乙两生提出的实验方案是否能制得氮化镁?(填“能”或“不能”)甲______乙_____。
(2)具体说明不能制得氮化镁的原因(如果两个方案都能制得氮化镁,此小题不用回答)。
答:________________________________________。
(1)甲不能,乙能(2)甲方案中反应产生的NH3全部被浓H2SO4吸收,不能进行后续反应
甲方案制得的NH3经过碱石灰干燥,再经过浓H2SO4时和硫酸反应生成(NH4)2SO4,使得反应到此终结,后边反应由于没有NH3无法进行,因此不能得到氮化镁,在这里,甲方案可以立即予以否定,即使本方案第4步也不合理,但已无须考虑和提出了。乙方案改正了甲方案的两点错误,NH3被CuO氧化成N2后,经过水洗除去未反应的NH3,最后氮气经浓H2SO4干燥后与高温镁粉反应得氮化镁,该方案是可行的。

练习册系列答案
相关题目

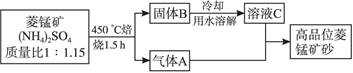
 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑