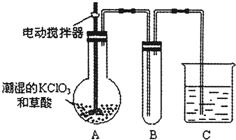
题目内容
为了探究HClO的漂白性,某同学设计了如图的实验.
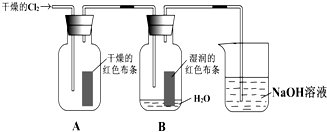
(1)实验室用二氧化锰与浓盐酸共热制得氯气,请写出发生反应的化学方程式______.
(2)通入Cl2后,从集气瓶A中干燥的红色布条不褪色的现象,可得出的结论是______;从集气瓶B中湿润的红色布条褪色的现象可得出的结论是______.
(3)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是______.

(1)实验室用二氧化锰与浓盐酸共热制得氯气,请写出发生反应的化学方程式______.
(2)通入Cl2后,从集气瓶A中干燥的红色布条不褪色的现象,可得出的结论是______;从集气瓶B中湿润的红色布条褪色的现象可得出的结论是______.
(3)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是______.
(1)实验室用二氧化锰与浓盐酸共热生成氯气、氯化锰和水,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,原理方程式为:Cl2+H2O=HCl+HClO,氯水具有漂白性;
故答案为:干燥的氯气没有漂白性;氯气和水反应生成的产物具有漂白性;
(3)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验;
故答案为:盐酸能否使红布条褪色.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,原理方程式为:Cl2+H2O=HCl+HClO,氯水具有漂白性;
故答案为:干燥的氯气没有漂白性;氯气和水反应生成的产物具有漂白性;
(3)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验;
故答案为:盐酸能否使红布条褪色.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目