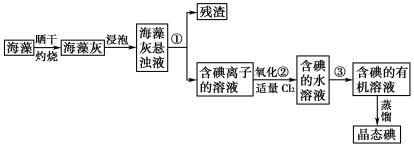
题目内容
【题目】汽车尾气污染是造成雾霾天气的重要原因之一,解决这个问题除了限制汽车出行外,更重要的是研发催化汽车尾气的转化技术,该技术中催化剂及载体的选择和改良是关键,某稀土催化剂催化转化汽车尾气示意图如图甲 
(1)下列有关说法正确的是 . a.C3H8与CH3CH=CH3一样,分子中碳原子都采用的是SP3杂化
b.N2、CO2、H2O都是非极性分子
c.每个CO2分子中,含有2个π键和2个σ键+
d.CO的一种等电子体为NO+ , 它的电子式为 ![]()
(2)CO与Fe可生成羰基铁[Fe(CO)5],已知其中铁为0价,铁原子的基态核外电子排布式为 , [Fe(CO)5],中配位原子是 , 理由是 .
(3)C、N、O三种元素的第一电离能由大到小的顺序是 , Al2O3晶体熔点高是耐火材料,AlCl3晶体易升华,熔点低,工业上电冶制取铝用前者而不用后者的原因是 .
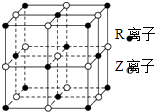
(4)钙钛矿型符合氧化物也可作为汽车尾气转化的催化剂,一种复合氧化物晶胞结构如图乙所示,则与每个Sr2+与个O2﹣紧邻,若Sr2+与紧邻O2﹣的核间距为apm,阿伏加德罗常数为NA , 则该氧化物晶体密度的计算表达式为 .
【答案】
(1)bd
(2)[Ar]3d64s2或者1s22s22p63s23p63d64s2;C;配体中C的电负性小于O,C原子核提供孤店子对配位能力强于O原子
(3)N>O>C;AlCl3晶体易升华,熔点低,是分子晶体,熔融时不导电,无法电解
(4)12;![]()
【解析】解:(1)a.C3H8分子中每个C含有4个σ键,且每个C原子价层电子对个数是4,则C原子采用sp3杂化;CH3CH=CH3分子中存在C﹣C单和C=C原子,且每个C原子价层电子对个数是4,则C原子采用sp3和sp2杂化,故a错误; b.N2是以非极性键结合的双原子一定为非极性分子,CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,H2O的立体构型为v型,结构对称,分子重心重叠,为非极性分子,故b正确;
c.CO2的结构式为O=C=O,中含有2个π键,2个σ键,故c错误;
d.CO的一种等电子体为NO+ , CO的结构为C≡O,则NO+的电子式为![]() , 故d正确;
, 故d正确;
所以答案是:bd;(2)Fe的原子序数为26,根据能量最低原理和洪特规则可写出基态Fe原子核外电子排布式为1s22s22p63s23p63d64s2或者[Ar]3d64s2 , [Fe(CO)5]中心原子是Fe,CO提供孤电子对为配体,配位原子是为C,理由是配体中C的电负性小于O,C原子核提供孤店子对配位能力强于O原子,
所以答案是:1s22s22p63s23p63d84s2或者[Ar]3d64s2;C;配体中C的电负性小于O,C原子核提供孤店子对配位能力强于O原子;(3)根据第一电离能的定义判断,指基态的气体原子失去一个电子形成+1价气态阳离子时所需的能量,即N>O>C;根据物质性质及晶体类型选择冶制金属的方法,因为AlCl3晶体易升华,熔点低,是分子晶体,熔融时不导电,无法电解所以电解Al2O3来制备金属铝,
所以答案是:N>O>C;AlCl3晶体易升华,熔点低,是分子晶体,熔融时不导电,无法电解;(4)Sr2+在晶胞的体心,与之紧邻的O2﹣在晶胞的棱上,12条棱,每个Sr2+紧邻的O2﹣有12;由晶胞结构得N(sr2+)=1,N(O2﹣)=12× ![]() =3,N(Ti4+)=8×
=3,N(Ti4+)=8× ![]() =1 所以晶胞的分子式为SrOTiO2则M=88+16+48+16×2=184g/mol,Z=1,∵Sr2+与紧邻O2﹣的核间距为apm,设晶胞的变成为x,则(2a)2=x2+x2解得x=
=1 所以晶胞的分子式为SrOTiO2则M=88+16+48+16×2=184g/mol,Z=1,∵Sr2+与紧邻O2﹣的核间距为apm,设晶胞的变成为x,则(2a)2=x2+x2解得x= ![]() a∴V=(
a∴V=( ![]() a×10﹣10)cm3 根据公式D=
a×10﹣10)cm3 根据公式D= ![]() =
= ![]() ,
,
所以答案是:12; ![]() .
.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案