��Ŀ����
����Ŀ��һ������Һ̬������XY2����һ������O2��ǡ����ȫȼ������Ӧ����ʽΪXY2(l)��3O2(g)��XO2(g)��2YO2(g)����ȴ���ڱ�״���²��������������672 mL���ܶ���2.56 g��L��1��
��1����ӦǰO2�������________mL(��״����)��
��2��������XY2��Ħ��������________��
��3����XY2������X��Y��Ԫ����������3��16����X��Y��Ԫ�طֱ���________��________(��Ԫ�ط���)��
���𰸡� 672mL 76g/mol C S
��������(1)����ʾ��ѧ����ʽ��XY2(l)��3O2(g)![]() XO2(g)��2YO2(g)����֪���÷�Ӧ��һ��Ӧǰ���������������ķ�Ӧ������Ӧǰ�����������ͬ����Ӧ���е�XY2ΪҺ̬���ʷ�ӦǰO2�����Ϊ672 mL��
XO2(g)��2YO2(g)����֪���÷�Ӧ��һ��Ӧǰ���������������ķ�Ӧ������Ӧǰ�����������ͬ����Ӧ���е�XY2ΪҺ̬���ʷ�ӦǰO2�����Ϊ672 mL��
(2)n(O2)��672��10��3L/22.4 L��mol��1��0.03 mol����XY2��O2ǡ����ȫ��Ӧ�������ǵ����ʵ���֮��Ϊ1��3(�ɻ�ѧ����ʽ֪)����XY2�����ʵ���Ϊ0.01 mol������Ӧ�������Ϊ
672 mL���ܶ�Ϊ2.56 g��L��1����Ӧ������������Ϊm����V��2.56 g��L��1��672��10��3L��1.72 g��
���������غ㶨��
m(XY2)��1.72 g��m(O2)
��1.72 g��0.03 mol��32 g��mol��1
��������0.76 g
M(XY2)��![]() ��76 g��mol��1
��76 g��mol��1
(3)������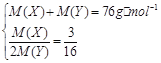
���![]()
��XΪ̼��YΪ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�