��Ŀ����
����Ŀ�����������һ���������������Ⱦ�Ϲ�ҵ��ij��ȤС�����Ʊ�Ca��NO3��2���������ʽ���̽���� �������زġ�
��NO+NO2+Ca��OH��2=Ca��NO3��2+H2O
��Ca��NO3��2�ܱ�����KmnO4��Һ������NO3�� �� MnO4������ԭΪMn2+
�������������£�Ca��NO3��2�ܽ�I������ΪI2 �� S2O32���ܽ�I2��ԭΪI��
���Ʊ��������
��1������ͬѧ��������ͼ��ʾװ���Ʊ�������� 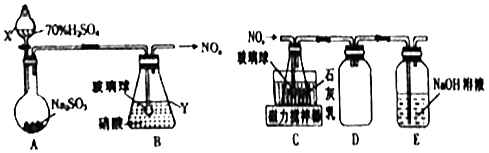
������X��Y�����Ʒֱ����� ��
��װ��B���ݳ���NO��NO2�����ʵ���֮��Ϊ1��1����װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2�����Ʊ�Ca��NO2��2�� ����ͬѧ������װ��B�в����ĵ��������Ʊ�Ca��NO2��2 �� װ��������ͼ��
��װ��C�е���ĩ�˽�һ������������� ��
��װ��D����������װ��E�������� ��
��3�����ⶨCa��NO2��2�Ĵ��ȡ� ����ͬѧ��ⶨCa��NO2��2�Ĵ��ȣ����ʲ��μӷ�Ӧ�����ɹ�ѡ����Լ���
a��ϡ���� b��c1molL��1��KI��Һ c��������Һ d��c2molL��1��Na2S2O3��Һe��c3molL��1������KMnO4��Һ
������Ca��NO2��2�Ļ�ԭ�����ⶨ���䴿�ȣ���ѡ����Լ���������ĸ����
������Ca��NO2��2�����������ⶨ�ȵIJ��裺ȷ��ȡmgCa��NO2��2��Ʒ������ƿ�У�������ˮ�ܽ⣬���벹������ʵ�鲽�裩
���𰸡�
��1����Һ©������ƿ��2SO2+H2O+2HNO3=NO+NO2+2H2SO4
��2��������ʯ����ĽӴ������������������δ��Ӧ�ĵ�������
��3��e�����������c1mol?L��1KI��Һ��������Һ��Ȼ��μ�ϡ���ᣬ��c2mol?L��1Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ����ȡ���ĵ�Na2S2O3��Һ������ظ����ϲ���2��3��
���������⣺��1���������������֪XΪ��Һ©����YΪ��ƿ�� ���Դ��ǣ���Һ©������ƿ����װ��B���ݳ���NO��NO2�����ʵ���֮��Ϊ1��1����װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ2SO2+H2O+2HNO3=NO+NO2+2H2SO4�����Դ��ǣ�2SO2+H2O+2HNO3=NO+NO2+2H2SO4����2����װ��C�е���ĩ�˽�һ�������������ʯ����ĽӴ������
���Դ��ǣ�������ʯ����ĽӴ��������װ��D�������Ƿ�������Eװ����������������δ��Ӧ��ĵ��������ֹ��Ⱦ������
���Դ��Ƕ������������δ��Ӧ�ĵ��������3��������ϢCa��NO2��2�ܱ�����KmnO4��Һ������NO3�� �� MnO4������ԭΪMn2+��֪��������Ca��NO2��2�Ļ�ԭ�����ⶨ�䴿�ȣ���ѡ����Լ���e��
���Դ��ǣ�e��������Ϣ�����������£�Ca��NO3��2�ܽ�I������ΪI2 �� S2O32���ܽ�I2��ԭΪI����֪��������Ca��NO2��2�����������ⶨ�䴿�ȵIJ����ǣ�ȷ��ȡ����Ϊm��Ca��NO2��2��Ʒ������ƿ�У�������ˮ�ܽ⣬���������c1 molL��1 KI��Һ��������Һ��Ȼ��μ�ϡ���ᣬ��c2 molL��1 Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ����ȡ���ĵ�Na2S2O3��Һ������ظ����ϲ���2��3�Σ�
���Դ��ǣ����������c1 molL��1 KI��Һ��������Һ��Ȼ��μ�ϡ���ᣬ��c2 molL��1 Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ����ȡ���ĵ�Na2S2O3��Һ������ظ����ϲ���2��3�Σ�

 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�