题目内容
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如下图所示:
下列描述正确的是
A.反应开始到10 s,用Z表示的反应速率为0.158 molL-1s-1
B.反应开始到10 s,X的物质的量浓度为减少了0.79 molL-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g) + Y(g)![]() Z(g)
Z(g)
【答案】C
【解析】
试题分析:由图像可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(Y):△n(X):△n(Z)=0.79mol:0.79mol:1.58mol=1:1:2,则反应的化学方程式为:X+Y![]() 2Z,则A.反应开始到10s,用Z表示的反应速率为
2Z,则A.反应开始到10s,用Z表示的反应速率为![]() =0.079mol/(Ls),A错误;B.由图像可知反应开始到10s,X的物质的量浓度减少了0.79mol÷2L=0.395mol/L,B错误;C.反应开始到10s时,Y的转化率为
=0.079mol/(Ls),A错误;B.由图像可知反应开始到10s,X的物质的量浓度减少了0.79mol÷2L=0.395mol/L,B错误;C.反应开始到10s时,Y的转化率为![]() ×100%=79.0%,C正确;D.由以上分析可知反应的化学方程式为:X+Y
×100%=79.0%,C正确;D.由以上分析可知反应的化学方程式为:X+Y![]() 2Z,D错误;答案选C。
2Z,D错误;答案选C。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】[化学——选修2:化学与技术]
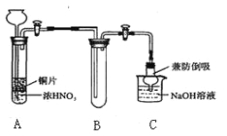
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
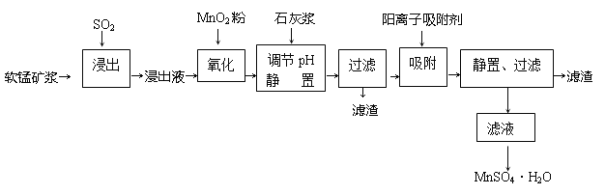
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。
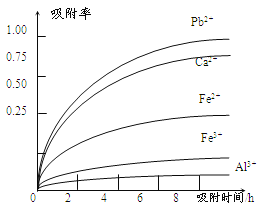
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图
离子 | 离子半径 (pm) | 开始沉淀时 的pH | 完全沉淀时 的pH |
Fe2+ | 74 | 7.6 | 9.7 |
Fe3+ | 64 | 2.7 | 3.7 |
Al3+ | 50 | 3.8 | 4.7 |
Mn2+ | 80 | 8.3 | 9.8 |
Pb2+ | 121 | 8.0 | 8.8 |
Ca2+ | 99 | - | - |
(1)浸出过程中生成Mn2+反应的化学方程式为___________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有______________________等(写二点)。
(5)吸附步骤除去的主要离子为___________________________。
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_______________。