题目内容
【题目】[化学——选修2:化学与技术]
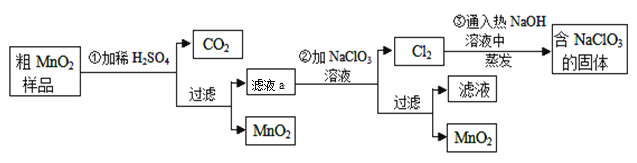
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。
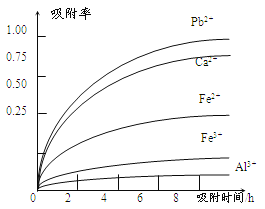
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图
离子 | 离子半径 (pm) | 开始沉淀时 的pH | 完全沉淀时 的pH |
Fe2+ | 74 | 7.6 | 9.7 |
Fe3+ | 64 | 2.7 | 3.7 |
Al3+ | 50 | 3.8 | 4.7 |
Mn2+ | 80 | 8.3 | 9.8 |
Pb2+ | 121 | 8.0 | 8.8 |
Ca2+ | 99 | - | - |
(1)浸出过程中生成Mn2+反应的化学方程式为___________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有______________________等(写二点)。
(5)吸附步骤除去的主要离子为___________________________。
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_______________。
【答案】(1)SO2+MnO2=MnSO4
(2)2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
(3)4.7≤pH<8.3(3分)
(4)吸附时间、金属离子半径、金属离子电荷
(5)Pb2+、Ca2+(2分);(6)Mn2+-2e-+2H2O=MnO2↓+4H+
【解析】
试题分析:(1)根据题意在浸出过程中生成Mn2+反应的化学方程式为SO2+MnO2=MnSO4;
(2)将Fe2+氧化为Fe3+过程中主要反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计。使Fe3+沉淀完全的pH为3.7,而Mn2+开始形成沉淀的pH为8.3,因此应调节pH的范围为4.7 ≤pH<8.3。
(4)根据题目提供的表格数据可知决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径 、金属离子的电荷;
(5)吸附步骤除去的主要离子为Pb2+、Ca2+;
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,Mn元素的化合价由+2价升高到+4价,失去2个电子发生氧化反应,用H+平衡电荷,用水配平原子,则该电解池的阳极的电极反应方程式为Mn2+-2e-+2H2O=MnO2↓+4H+。

【题目】如右图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出。符合这一情况的是下表中的( )
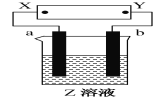
选项 | a极板 | b极板 | X极 | Z溶液 |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |