题目内容
【题目】化学工作者一直在积极探索影响大气质量的因素及改善措施。
(1)硫酸盐是大气中可吸入颗粒物的主要成分之一,是在含水的气溶胶液滴中通过化学反应产生的。
①气溶胶属于胶体分散系。当日光射入充满气溶胶的暗室时,可观察到_______效应。
②大气中的SO2转化为硫酸盐的过程中,以下物质能起氧化作用的是_____(填字母序号)。
a.O2 b.H2S c.NH3 d.O3
③有研究者发现特定条件下,大气中的NOx会成为氧化SO2的主要物质,于是认为,当城市大气中的可吸入颗粒物严重超标时,应采取汽车限行措施。原因是_________。
(2)燃煤烟气中含有NOx和SO2。工业上常用亚氯酸钠(NaClO2)对燃煤烟气进行脱硝和脱硫处理。
已知:酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,可氧化NOx或SO2。
I.在实验室模拟脱硝过程:调节NaClO2吸收液的pH为5,向其中通入含NO的模拟烟气。
①测得脱硝反应后,溶液中的阴离子为NO3-和Cl-,则脱硝反应的离子方程式为_______。
②测得脱硝效率(即NO的吸收率)随温度变化的曲线如下图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硝效率下降的原因是____________。

Ⅱ.在实验室模拟同时脱硝、脱硫过程:调节NaClO2吸收液的pH为5,向其中通入含SO2和NO(体积比2:1)的模拟烟气。
③测得脱硝、脱硫反应后,溶液中的阴离子为NO3-、SO42-和Cl-,其中c(SO42-)=amol/L,c(Cl-)=bmol/L,已知脱硫效率为100%,计算脱硝效率为_________。
【答案】 丁达尔 ad 汽车尾气中含NOx,能将SO2氧化成硫酸盐,从而增加大气中可吸入颗粒物含量 5NO + 3ClO2 + 4H2O ![]() 5NO3- + 3Cl- + 8H+(或4NO + 3ClO2- + 2H2O
5NO3- + 3Cl- + 8H+(或4NO + 3ClO2- + 2H2O ![]() 4NO3- + 3Cl- + 4H+) 吸收液pH为5,显酸性,NaClO2转化成ClO2,温度升高, ClO2气体容易从溶液体系中逸出,使脱硝反应难以发生 [(8b-4a)/3a]×100%
4NO3- + 3Cl- + 4H+) 吸收液pH为5,显酸性,NaClO2转化成ClO2,温度升高, ClO2气体容易从溶液体系中逸出,使脱硝反应难以发生 [(8b-4a)/3a]×100%
【解析】(1)考查胶体性质、SO2的性质,①胶体具有丁达尔效应,因此当日光摄入充满气溶胶的暗室时,可观察到丁达尔效应;②a、空气中有氧气,氧气具有氧化性,能把SO2氧化成SO42-,故a正确;b、空气中不含有H2S,且H2S只具有还原性,故b错误;c、空气中不含NH3,NH3表现还原性,故c错误;d、大气中含有O3,O3表现强氧化性,能把SO2氧化成SO42-,故d正确;③汽车尾气中含NOx,能将SO2氧化成硫酸盐,从而增加大气中可吸入颗粒物含量;(2)考查离子方程式的书写、化学反应条件的控制、化学计算,①根据信息,NaClO表现强氧化性,把NO氧化成NO3-,本身被还原成Cl-,ClO2-+NO→Cl-+NO3-,根据化合价升降法进行配平,即为3ClO2-+4NO→4NO3-+3Cl-。根据原子守恒以及电荷守恒,离子反应方程式为4NO + 3ClO2- + 2H2O=4NO3- + 3Cl- + 4H+,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,可氧化NOx或SO2,pH=5的溶液显酸性,ClO2-生成ClO2和Cl-,ClO2把NO氧化成NO3-,本身被还原成Cl-,离子方程式为 5NO + 3ClO2 + 4H2O=5NO3- + 3Cl- + 8H+;②吸收液pH为5,显酸性,NaClO2转化成ClO2,温度升高, ClO2气体容易从溶液体系中逸出,使脱硝反应难以发生;③根据得失电子数目守恒,因此有4b=2a+3c(NO3-),解得实际上得到c(NO3-)=(4b-2a)/3mol·L-1,因为SO2和NO的体积比为2:1,且脱硫效率为100%,因此理论上得到c(NO3-)=a/2mol·L-1,即脱硝率为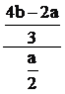 ×100%=[(8b-4a)/3a]×100%。
×100%=[(8b-4a)/3a]×100%。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填空.
(1)如图1是常见仪器的部分结构.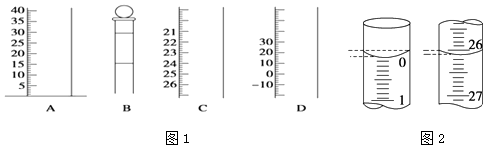
①写出仪器名称BC
②使用前需检查是否漏水的仪器有 .
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 滴定终点时,锥形瓶中颜色变化为 , 且半分钟内颜色不复原.
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图2所示,所用盐酸溶液的体积为mL.
(5)某学生根据3次实验分别记录有关数据如表:
滴定 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)


