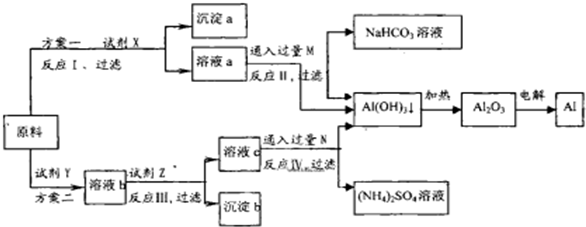
题目内容
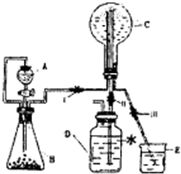
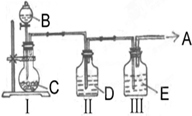 (1)实验室中制取少量干燥纯净的气体A,可用如图装置.
(1)实验室中制取少量干燥纯净的气体A,可用如图装置.说明:Ⅰ中的漏斗为分液漏斗,转动活塞可以控制液体滴加的速率
①若A可以灭火,则A物质是
②若C物质是淡黄色粉末,则不需要Ⅲ装置,A物质是
(2)选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取分液法 B.加热分解 C.蒸发结晶法 D.分液法 E.渗析法 F.蒸馏法 G.过滤法
①
②
③
分析:(1)①常用于灭火的气体为二氧化碳,实验室中一般使用稀盐酸与碳酸钙反应制取二氧化碳;氯化氢具有挥发性,必须将二氧化碳中的氯化氢利用饱和碳酸氢钠除去;然后用浓硫酸干燥二氧化碳,据此进行解答;
②淡黄色粉末为过氧化钠,B中液体为水,过氧化钠与水反应生成氢氧化钠和氧气,然后使用浓硫酸干燥即可;
(2)①从可溶性溶液中获得固体,提纯采用蒸发结晶法;
②溴单质在水中溶解度较小,易溶于有机溶剂,可以使用萃取分液法分离;
③水和酒精互溶,可以根据二者的沸点不同,通过蒸馏法分离.
②淡黄色粉末为过氧化钠,B中液体为水,过氧化钠与水反应生成氢氧化钠和氧气,然后使用浓硫酸干燥即可;
(2)①从可溶性溶液中获得固体,提纯采用蒸发结晶法;
②溴单质在水中溶解度较小,易溶于有机溶剂,可以使用萃取分液法分离;
③水和酒精互溶,可以根据二者的沸点不同,通过蒸馏法分离.
解答:解:(1)若A可以灭火,则A为CO2,通常使用碳酸钙与盐酸反应制取二氧化碳,盐酸具有挥发性,制取的二氧化碳中混有氯化氢气体,应该使用饱和NaHCO3溶液除去二氧化碳中的杂质HCl,然后使用浓H2SO4干燥,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CO2;饱和NaHCO3溶液;除HCl;浓H2SO4;CaCO3+2H+=Ca2++CO2↑+H2O;
②C物质是淡黄色粉末,则B中分液漏斗中盛放的为水,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:O2;H2O;2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)①从氯化钠溶液中获得氯化钠固体,可以通过蒸发结晶法将二者分离,故答案为:C;
②分离溴水中的溴和水,溴易溶于有机溶剂,可以通过萃取分液法将溴和水分离,故答案为:A;
③分离水和酒精,水和酒精相互溶解,可以通过蒸馏的方法将酒精和水分离,故答案为:F.
故答案为:CO2;饱和NaHCO3溶液;除HCl;浓H2SO4;CaCO3+2H+=Ca2++CO2↑+H2O;
②C物质是淡黄色粉末,则B中分液漏斗中盛放的为水,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:O2;H2O;2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)①从氯化钠溶液中获得氯化钠固体,可以通过蒸发结晶法将二者分离,故答案为:C;
②分离溴水中的溴和水,溴易溶于有机溶剂,可以通过萃取分液法将溴和水分离,故答案为:A;
③分离水和酒精,水和酒精相互溶解,可以通过蒸馏的方法将酒精和水分离,故答案为:F.
点评:本题考查了常见气体的制备原理、物质的分离与提纯方法及应用,题目难度不大,注意掌握常见的气体制备方法及装置选择方法,明确分离和提纯物质常用的方法.

练习册系列答案
相关题目