题目内容
(2013?红桥区二模)某研究性学习小组用不纯的氧化铝(杂质为Fe2O3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):
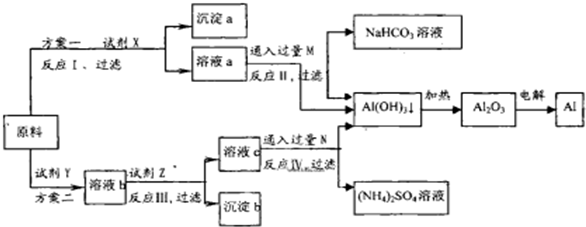
(1)试剂X的化学式为
实验室配制480mL 1mol?L-1 X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3].从实际工业的角度,你认为方案
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验.
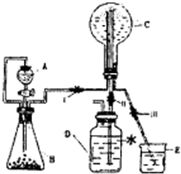
①仪器A的名称是
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的
A.生石灰 B.烧碱 C.胆矾 D.碱石灰
(4)若D中事先滴入少量酚酞,则C中液体呈

(1)试剂X的化学式为
NaOH
NaOH
,反应I的离子方程式是Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
.实验室配制480mL 1mol?L-1 X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有
500mL容量瓶
500mL容量瓶
.常用来可以标定所配X的溶液浓度是否准确的实验名称是中和滴定
中和滴定
.(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3].从实际工业的角度,你认为方案
方案一
方案一
更合理,理由是步骤少,操作简单
步骤少,操作简单
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验.

①仪器A的名称是
分液漏斗
分液漏斗
,装置中A口部和B口部之间联通导气管的作用是平衡分液漏斗内外压强,防止分液漏斗堵塞
平衡分液漏斗内外压强,防止分液漏斗堵塞
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的
C
C
(填字母序号).A.生石灰 B.烧碱 C.胆矾 D.碱石灰
(4)若D中事先滴入少量酚酞,则C中液体呈
红
红
色,用离子方程式解释原因NH3+H2O?NH3?H2O?NH4++OH-
NH3+H2O?NH3?H2O?NH4++OH-
.分析:(1)方案一:由溶液a通入过量的M生成氢氧化铝沉淀、碳酸氢钠可知,溶液a中含有偏铝酸根、气体M为二氧化碳,故试剂X为氢氧化钠溶液,反应I为氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水;
实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL1mol?L-1 NaOH的溶液需要玻璃仪器有:烧杯、玻璃棒、试剂瓶、胶头滴管、500mL容量瓶;
可以利用中和滴定方法以标定所配NaOH溶液浓度是否准确;
(2)方案二:由溶液c通入过量的N生成氢氧化铝沉淀、硫酸铵可知,溶液c中含有铝离子、N为氨气,故试剂Y为硫酸,溶液b中含有硫酸铝、硫酸铁,调节PH值,是铁离子转化为氢氧化铁,过滤后,再向滤液中加入过量的氨水沉淀铝离子,
与方案一相比较,方案一步骤少,操作简单;
(3)①、仪器A是分液漏斗,装置中A口部和B口部之间联通导气管的作用是:平衡内外压强,防止分液漏斗堵塞;
故答案为:分液漏斗;平衡内外压强,防止分液漏斗堵塞;
②、A中盛有浓氨水,存在平衡NH3+H2O?NH3?H2O?NH4++OH-,则B装置中的固体试剂为可溶性碱或能与水反应的碱性氧化物;
(4)氨气溶于水,反应生成一水合氨,一水合氨电离生成铵根离子与氢氧根离子,溶液呈碱性,酚酞在碱性条件下呈红色.
实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL1mol?L-1 NaOH的溶液需要玻璃仪器有:烧杯、玻璃棒、试剂瓶、胶头滴管、500mL容量瓶;
可以利用中和滴定方法以标定所配NaOH溶液浓度是否准确;
(2)方案二:由溶液c通入过量的N生成氢氧化铝沉淀、硫酸铵可知,溶液c中含有铝离子、N为氨气,故试剂Y为硫酸,溶液b中含有硫酸铝、硫酸铁,调节PH值,是铁离子转化为氢氧化铁,过滤后,再向滤液中加入过量的氨水沉淀铝离子,
与方案一相比较,方案一步骤少,操作简单;
(3)①、仪器A是分液漏斗,装置中A口部和B口部之间联通导气管的作用是:平衡内外压强,防止分液漏斗堵塞;
故答案为:分液漏斗;平衡内外压强,防止分液漏斗堵塞;
②、A中盛有浓氨水,存在平衡NH3+H2O?NH3?H2O?NH4++OH-,则B装置中的固体试剂为可溶性碱或能与水反应的碱性氧化物;
(4)氨气溶于水,反应生成一水合氨,一水合氨电离生成铵根离子与氢氧根离子,溶液呈碱性,酚酞在碱性条件下呈红色.
解答:解:(1)方案一:由溶液a通入过量的M生成氢氧化铝沉淀、碳酸氢钠可知,溶液a中含有偏铝酸根、气体M为二氧化碳,故试剂X为NaOH溶液,反应I为氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL1mol?L-1 NaOH的溶液需要玻璃仪器有:烧杯、玻璃棒、试剂瓶、胶头滴管、500mL容量瓶,故缺少500mL容量瓶,
可以利用中和滴定方法以标定所配NaOH溶液浓度是否准确;
故答案为:NaOH;Al2O3+2OH-═2AlO2-+H2O;500mL容量瓶;中和滴定;
(2)方案二:由溶液c通入过量的N生成氢氧化铝沉淀、硫酸铵可知,溶液c中含有铝离子、N为氨气,故试剂Y为硫酸,溶液b中含有硫酸铝、硫酸铁,调节PH值,是铁离子转化为氢氧化铁,过滤后,再向滤液中加入过量的氨水沉淀铝离子,
与方案一相比较,方案一步骤少,操作简单,故方案一更合理,
故答案为:方案一;步骤少,操作简单;
(3)①、仪器A是分液漏斗,装置中A口部和B口部之间联通导气管的作用是:平衡分液漏斗内外压强,防止分液漏斗堵塞;
②、A中盛有浓氨水,与生石灰、烧碱、碱石灰混合,放出大量的热,溶液中氢氧根离子浓度增大,利用氨气逸出,产生大量的氨气,氨水与胆矾反应生成氢氧化铜沉淀,不能产生氨气,故C不能可以,
故答案为:C;
(4)氨气溶于水,反应生成一水合氨,一水合氨电离出氢氧根,NH3+H2O?NH3?H2O?NH4++OH-,溶液呈碱性,酚酞在碱性条件下呈红色,
故答案为:红;NH3+H2O?NH3?H2O?NH4++OH-.
实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL1mol?L-1 NaOH的溶液需要玻璃仪器有:烧杯、玻璃棒、试剂瓶、胶头滴管、500mL容量瓶,故缺少500mL容量瓶,
可以利用中和滴定方法以标定所配NaOH溶液浓度是否准确;
故答案为:NaOH;Al2O3+2OH-═2AlO2-+H2O;500mL容量瓶;中和滴定;
(2)方案二:由溶液c通入过量的N生成氢氧化铝沉淀、硫酸铵可知,溶液c中含有铝离子、N为氨气,故试剂Y为硫酸,溶液b中含有硫酸铝、硫酸铁,调节PH值,是铁离子转化为氢氧化铁,过滤后,再向滤液中加入过量的氨水沉淀铝离子,
与方案一相比较,方案一步骤少,操作简单,故方案一更合理,
故答案为:方案一;步骤少,操作简单;
(3)①、仪器A是分液漏斗,装置中A口部和B口部之间联通导气管的作用是:平衡分液漏斗内外压强,防止分液漏斗堵塞;
②、A中盛有浓氨水,与生石灰、烧碱、碱石灰混合,放出大量的热,溶液中氢氧根离子浓度增大,利用氨气逸出,产生大量的氨气,氨水与胆矾反应生成氢氧化铜沉淀,不能产生氨气,故C不能可以,
故答案为:C;
(4)氨气溶于水,反应生成一水合氨,一水合氨电离出氢氧根,NH3+H2O?NH3?H2O?NH4++OH-,溶液呈碱性,酚酞在碱性条件下呈红色,
故答案为:红;NH3+H2O?NH3?H2O?NH4++OH-.
点评:本题以框图题形式考查铝、铁的化合物的性质、对工艺流程的理解、氨气的制备与性质等,难度中等,清楚工艺流程原理是解题的关键,是对知识迁移的综合运用.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
 (2013?红桥区二模)如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其他条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,开始时容器的体积均为VL,发生反应2X(?)+Y(?)?aZ(g)并达到平衡状态此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断正确的是( )
(2013?红桥区二模)如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其他条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,开始时容器的体积均为VL,发生反应2X(?)+Y(?)?aZ(g)并达到平衡状态此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断正确的是( ) (2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
(2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.