题目内容
(2011?甘肃二模)已知X+、Y3+、Z-、W2-分别是短周期元素X、Y、Z、W形成的离子,且X+比Z-少一个电子层.下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物,常温下对应溶液的pH如图: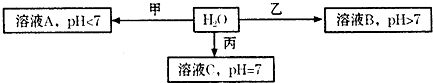
请回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,写出在实验室中制取该物质的化学方程式
(2)①甲的化学式是
②若W2-和Z-具有相同电子层结构,则离子半径大小顺序为(用离子符号表示)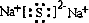
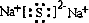 ;溶液B的pH大于7的原因
;溶液B的pH大于7的原因
(3)化合物丙在固态时的晶体类型是

请回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,写出在实验室中制取该物质的化学方程式
4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
| ||
4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
.
| ||
(2)①甲的化学式是
AlCl3
AlCl3
乙的化学式可能是Na2S或Na2O
Na2S或Na2O
;②若W2-和Z-具有相同电子层结构,则离子半径大小顺序为(用离子符号表示)
S2->Cl-
S2->Cl-
,乙的电子式是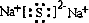
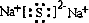
S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
.(用离子方程式表示)(3)化合物丙在固态时的晶体类型是
离子晶体
离子晶体
.分析:X+、Y3+、Z-、W2-分别是短周期元素X、Y、Z、W形成的离子,Z的单质是一种黄绿色气体,则Z为Cl,且X+比Z-少一个电子层,则X为Na,由W2-可知,W为O或S,由Y3+可知,Y应为Al,
结合图中转化可知,溶液A的pH<7,溶液B的pH>7,则甲为AlCl3,乙为Na2S或Na2O,溶液C的pH=7,则丙为NaCl,结合化学用语、水解、晶体类型来解答.
结合图中转化可知,溶液A的pH<7,溶液B的pH>7,则甲为AlCl3,乙为Na2S或Na2O,溶液C的pH=7,则丙为NaCl,结合化学用语、水解、晶体类型来解答.
解答:解:X+、Y3+、Z-、W2-分别是短周期元素X、Y、Z、W形成的离子,Z的单质是一种黄绿色气体,则Z为Cl,且X+比Z-少一个电子层,则X为Na,由W2-可知,W为O或S,由Y3+可知,Y应为Al,结合图中转化可知,溶液A的pH<7,溶液B的pH>7,则甲为AlCl3,乙为Na2S或Na2O,溶液C的pH=7,则丙为NaCl,
(1)实验室利用浓盐酸与MnO2反应来制取氯气,反应方程式为4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O;
(2)①溶液A的pH<7,溶液B的pH>7,则甲为AlCl3,乙为Na2S或Na2O,故答案为:AlCl3;Na2S或Na2O;
②Z为Cl,由W2-和Z-具有相同电子层结构,则W为S,原子序数大的离子半径小,则离子半径为S2->Cl-,乙为Na2S,
其电子式为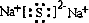 ,溶液B的pH>7,是因硫离子水解使溶液显碱性,水解离子反应为S2-+H2O?HS-+OH-,
,溶液B的pH>7,是因硫离子水解使溶液显碱性,水解离子反应为S2-+H2O?HS-+OH-,
故答案为:S2->Cl-;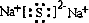 ;S2-+H2O?HS-+OH-;
;S2-+H2O?HS-+OH-;
(3)丙为NaCl,是由离子构成的化合物,则属于离子晶体,故答案为:离子晶体.
(1)实验室利用浓盐酸与MnO2反应来制取氯气,反应方程式为4HCl(浓)+MnO2
| ||
故答案为:4HCl(浓)+MnO2
| ||
(2)①溶液A的pH<7,溶液B的pH>7,则甲为AlCl3,乙为Na2S或Na2O,故答案为:AlCl3;Na2S或Na2O;
②Z为Cl,由W2-和Z-具有相同电子层结构,则W为S,原子序数大的离子半径小,则离子半径为S2->Cl-,乙为Na2S,
其电子式为
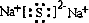 ,溶液B的pH>7,是因硫离子水解使溶液显碱性,水解离子反应为S2-+H2O?HS-+OH-,
,溶液B的pH>7,是因硫离子水解使溶液显碱性,水解离子反应为S2-+H2O?HS-+OH-,故答案为:S2->Cl-;
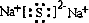 ;S2-+H2O?HS-+OH-;
;S2-+H2O?HS-+OH-;(3)丙为NaCl,是由离子构成的化合物,则属于离子晶体,故答案为:离子晶体.
点评:本题考查无机物的推断,明确转化中的物质与离子的关系、离子的水解等是解答本题的关键,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目