题目内容
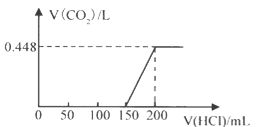
【题目】某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2 (标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。则该混合溶液中NaOH与Na2CO3物质的量之比为:
A. 1 : 1 B. 2 : 1 C. 1 : 3 D. 3 : 1
【答案】B
【解析】试题分析:向该含有NaOH与Na2CO3的溶液中逐滴加入稀盐酸至过量,先后发生的反应为①HCl+NaOH=NaCl+H2O,②Na2CO3+HCl=NaHCO3+NaCl,③NaHCO3+HCl=NaCl+CO2↑+H2O。由生成的CO2 (标准状况)与加入的盐酸体积关系示意图可知,反应③消耗盐酸50mL(150~200),生成CO2 0.448L(即0.02mol),由碳元素守恒可知混合物中含碳酸钠0.02mol,由反应③可知50mL盐酸中n(H+)=0.02mol,所以该盐酸的物质的量浓度为0.4mol/L。因为反应②和反应③消耗的盐酸相同,所以反应①消耗的盐酸的体积为150mL-50mL=100mL,则100mL盐酸中n(H+)=0.04mol。n(NaOH)= n(H+)=0.04mol,该混合溶液中NaOH与Na2CO3物质的量之比为2:1,B正确,本题选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目