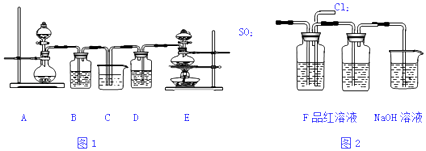
题目内容
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表.下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10﹣5mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
【答案】C
【解析】解:A、由表中数据可求得前2min内生成Z为0.08mol,故 ![]() ,故A错误;B、该反应的正反应是放热反应,降低温度平衡正向移动,反应达到新平衡前v(逆)<v(正),故B错误;
,故A错误;B、该反应的正反应是放热反应,降低温度平衡正向移动,反应达到新平衡前v(逆)<v(正),故B错误;
C、由表中数据可知7min时,反应到达平衡,Y的物质的量为0.10mol,此时X的物质的量也为0.10mol,Z的物质的量也为0.12mol,X、Y、Z的物质的量浓度分别为:0.01molL﹣1、0.01molL﹣1、0.012molL﹣1 , 故平衡常数 ![]() ,故C正确;
,故C正确;
D、因该反应前后气体的体积不变,其他条件不变,再充入0.2 mol Z,因为在等温等容条件下,左右气体化学计量数相等,原平衡环境和D 选项的平衡环境互为等效平衡,平衡不移动,X的体积分数不变,故D错误.
故选C.
【考点精析】通过灵活运用化学平衡状态本质及特征和化学平衡的计算,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分FeTiO3 , 钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1: 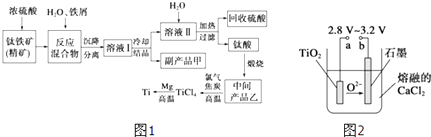
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4 , 反应中无气体生成.副产品甲阳离子是 .
(2)上述生产流程中加入铁屑的目的是 .
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10﹣16 | 1.0×10﹣29 | 1.8×10﹣11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018molL﹣1 , 当溶液的pH等于时,Mg(OH)2开始沉淀.
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是 .
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的极,阴极的电极反应式 .