题目内容
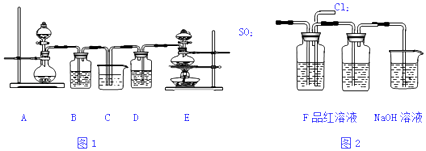
【题目】关于下列各实验装置图的叙述中,正确的是( ) 
A.装置①可用于分离碘和氯化钠的固体混合物
B.装置②可用于吸收HCl或NH3气体
C.装置③可用于分解NH4HCO3制备NH3
D.装置④b口进气可收集CO2或NO气体
【答案】C
【解析】解:A.碘易升华,可用升华的方法分离,故A错误;B.HCl或NH3气体易溶于水,应用四氯化碳防止倒吸,故B错误;
C.NH4HCO3分解生成氨气,生成的二氧化碳用碱石灰吸收,可用于制备氨气,故C正确;
D.二氧化碳密度比空气大,应用向上排空法收集,NO不能排空气法收集,故D错误.
故选C.
A.分离碘和氯化钠的固体,可用升华的方法;
B.HCl或NH3气体易溶于水,不能防止倒吸;
C.NH4HCO3分解生成氨气,生成的二氧化碳用碱石灰吸收;
D.二氧化碳密度比空气大,NO不能排空气法收集.

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分FeTiO3 , 钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1: 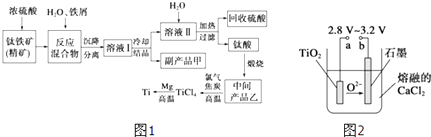
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4 , 反应中无气体生成.副产品甲阳离子是 .
(2)上述生产流程中加入铁屑的目的是 .
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10﹣16 | 1.0×10﹣29 | 1.8×10﹣11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018molL﹣1 , 当溶液的pH等于时,Mg(OH)2开始沉淀.
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是 .
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的极,阴极的电极反应式 .
【题目】短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是
X | ||
Y | ||
Z |
A. X,Y,Z中X的单质最稳定B. Y的氢化物为HY
C. X能生成HXOD. 能发生Cl2+H2Z = Z+2HCl的反应
【题目】某同学做如表实验:下列说法正确的是( )
装 |
|
|
现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
A.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀
B.铁片Ⅳ的电极反应式可能为Fe﹣3e﹣=Fe3+
C.用K3Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极
D.铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等