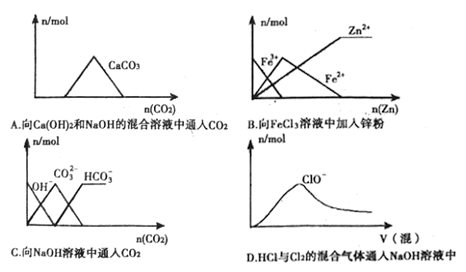
题目内容
【题目】常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是![]()
![]()
A.b一定显中性B.b可能显碱性或酸性
C.a不可能显酸性D.a可能显酸性或碱性
【答案】D
【解析】
如果酸是强酸,pH为3的强酸溶液与pH为11的氢氧化钠等体积混合,两者恰好完全反应,得到强酸强碱溶液,溶液呈中性,pH为3的强酸溶液与pH为11的氨水等体积混合,氨水的浓度远远大于酸的浓度,氨水过量,因此混合溶液呈碱性;
如果酸是弱酸,pH为3的弱酸溶液与pH为11的氢氧化钠等体积混合,酸的浓度远远大于NaOH的浓度,酸过量,溶液呈酸性,pH为3的弱酸溶液与pH为11的氨水等体积混合,由于酸的电离程度未知,因此可能是正好反应,也可能是酸过量,也可能是碱过量,混合溶液可能呈中性、酸性或碱性;
根据以上分析,a溶液可能呈中性、酸性或碱性,b溶液只可能呈中性或酸性。
故选D。

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目