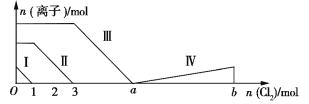
题目内容
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 1 mol硫单质在过量氧气中燃烧产生NA个SO3分子
B. 标准状况下,22.4 L SO3中含有氧原子数为3NA
C. 标准状况下,18 g H2O中含有氧原子数为NA
D. 5.4 g铝单质与足量NaOH溶液反应,转移电子数为0.6NA
【答案】CD
【解析】
A. 硫单质在氧气中燃烧生成的是二氧化硫;
B. 标准状况下三氧化硫的状态不是气体;
C. 根据n = ![]() 计算出水的物质的量,再结合水分子的分子构成得出结论;
计算出水的物质的量,再结合水分子的分子构成得出结论;
D. 铝为+3价金属,根据n = ![]() 计算出铝的物质的量,然后计算出转移电子的物质的量。
计算出铝的物质的量,然后计算出转移电子的物质的量。
A. 1mol硫单质在过量氧气中燃烧产生1mol二氧化硫,产生NA个SO2分子,不会生成三氧化硫,故A项错误;
B. 标准状况下SO3不是气体,不能使用标况下的气体摩尔体积计算,故B项错误;
C.18 g水的物质的量为n = ![]() = 1 mol,因一个水分子中含有一个氧原子,所以1 mol水中所含的氧原子物质的量为1mol,即氧原子个数为NA,故C项正确;
= 1 mol,因一个水分子中含有一个氧原子,所以1 mol水中所含的氧原子物质的量为1mol,即氧原子个数为NA,故C项正确;
D. 5.4 g铝的物质的量为:n = ![]() = 0.2 mol,0.2 mol Al与氢氧化钠溶液完全反应生成偏铝酸根,失去0.6 mol电子,因此转移电子数为0.6 NA,故D项正确;
= 0.2 mol,0.2 mol Al与氢氧化钠溶液完全反应生成偏铝酸根,失去0.6 mol电子,因此转移电子数为0.6 NA,故D项正确;
答案选CD。

 阅读快车系列答案
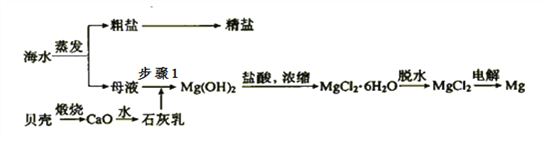
阅读快车系列答案【题目】以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
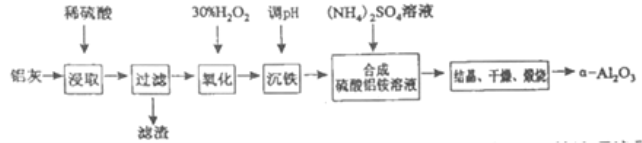
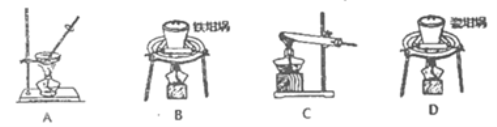
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号).
(2)流程中加入H2O2有气体产生,原因是___________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.己知:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
为保证产品的纯度,可以选用下列物质中的____调节溶液pH(填字母),调节pH的范围为_____。
a.A12O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
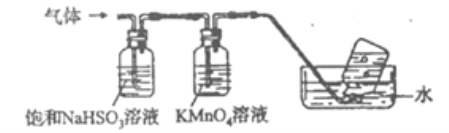
①集气瓶中收集到的气体是______(填化学式).
②装有KMnO4溶液洗气瓶的作用是________。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________,写出硫酸铝铵加入足量该试剂的离子方程式_________________。