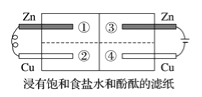
题目内容
【题目】熔触的金属锡在300℃左右能直接与氯气作用生成四氯化锡。四氯化锡的熔点-33℃,沸点114℃,遇潮湿空气水解。某学习小组用以下装置制取少量四氯化锡。回答下列问题:
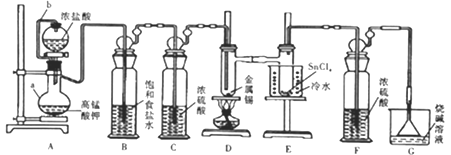
(1)仪器组装完毕,为检查装置的气密性,将装置G中漏斗改为导管且管口浸没于水中,后续操作是__________,说明气密性良好。
(2)仪器a的名称是__________;设计连接管b的目的是_______________。
(3)装置B、F的作用分別是______________、____________。
(4)装置A中反应的离子方程式为______________,排尽装置中的空气后才能点燃D处的酒精灯,判断装置中的空气已排尽的现象是_____________;D中加热的作用之一是加快氯气与金属锡反应,另一作用是__________。
(5)四氯化锡遇潮湿空气时有白色烟雾产生,同时生成白色固体(SnO2·xH2O),该反应的化学方程式为_____________。
(6)实验结束后,若制得SnCl4的质量为2.61g,Cl2的转化率为80%,则消耗KmnO4的质量为__________。
【答案】 用热毛巾捂住烧瓶,导管口有气泡逸出,停止加热后,导管口水回流,形成一段水柱 蒸馏烧瓶 避免加料时需打开分液漏斗上口玻璃塞,浓盐酸挥导致成污染 除去氯气中的氯化氢 防止水蒸气由G进入E,使产品水解 2MnO4-+16H++10Cl- = 2Mn2++5Cl2 ↑+8H2O 装置中充满黄绿色气体 促进SnCl4气化,从反应混合物中分离 SnCl4 +(x+2)H2O =SnO2·xH2O↓+ 4HCl↑ 1.58 g
【解析】试题分析:(1)根据气密性检验的方法回答。
(2)仪器a的名称是蒸馏烧瓶;连接管b能平衡烧瓶和漏斗中的压强。
(3)饱和食盐水除去氯气中的氯化氢、浓硫酸可以干燥氯气。
(4)装置A中高锰酸钾与浓盐酸反应生成氯气,根据氯气的颜色,判断装置中的空气已排尽的现象;根据金属锡在300℃左右能直接与氯气作用生成四氯化锡。四氯化锡的熔点-33℃,沸点114℃,分析D中加热的作用。
(5)四氯化锡遇潮湿空气时生成白色固体(SnO2·xH2O)和氯化氢。
(6)根据化学方程式计算。
解析:(1)仪器组装完毕,为检查装置的气密性,将装置G中漏斗改为导管且管口浸没于水中,用热毛巾捂住烧瓶,导管口有气泡逸出,停止加热后,导管口水回流,形成一段水柱,说明气密性良好。
(2)仪器a的名称是蒸馏烧瓶;连接管b能平衡烧瓶和漏斗中的压强,避免加料时需打开分液漏斗上口玻璃塞,浓盐酸挥导致成污染。
(3) 饱和食盐水除去氯气中的氯化氢、浓硫酸可以干燥氯气,装置B、F的作用分別是除去氯气中的氯化氢、干燥氯气防止水蒸气由G进入E,使产品水解。
(4) 装置A中高锰酸钾与浓盐酸反应生成氯气,反应的离子方程式为2MnO4-+16H++10Cl- = 2Mn2++5Cl2 ↑+8H2O ,氯气是黄绿色气体,判断装置中的空气已排尽的现象是装置中充满黄绿色气体;金属锡在300℃左右能直接与氯气作用生成四氯化锡。四氯化锡的熔点-33℃,沸点114℃,D中加热的作用之一是加快氯气与金属锡反应,另一作用是促进SnCl4气化,从反应混合物中分离。
(5) 四氯化锡遇潮湿空气时生成白色固体(SnO2·xH2O)和氯化氢,该反应的化学方程式为SnCl4 +(x+2)H2O =SnO2·xH2O↓+ 4HCl↑。
(6) 若制得SnCl4的质量为2.61g,Cl2的转化率为80%,则需要制备氯气的质量![]() 1.775g,则消耗KmnO4的质量为__________。
1.775g,则消耗KmnO4的质量为__________。

所以x=1.58 g

 阅读快车系列答案
阅读快车系列答案