题目内容
【题目】硫元素有多种化合价,可形成多种化合物。 H2S和SO2在工农业生产中具有重要应用。
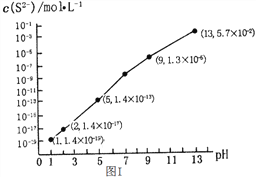
(1)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图I所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol/L;
②某溶液含0.01 mol/LFe2+、未知浓度的Mn2+和0.10 mol/L H2S,当溶液pH=________时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中![]() =____________。
=____________。
【已知:KSP(FeS)=1.4×10-19,KSP(MnS)=2.8×10-13】
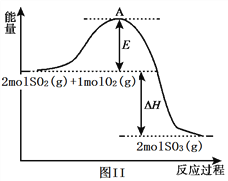
(2) 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+1/2O2(g)![]() SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
①图II中ΔH=____________ kJ/mol;该反应通常用V2O5作催化剂,加V2O5会使图中A点降低,原因是_____________________________________________________ 。
②该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)______ v(逆)(填“<”、“>”或“=”)。
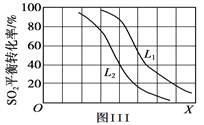
③L(L1、L2)、X可分别代表压强或温度。图III表示L一定时,SO2(g)的平衡转化率随X的变化关系。则X代表的物理量是____________;L1、L2的大小关系为L1_________L2(填“<”、“>”或“=”)。
【答案】 0.043 2 2.0×106 -198 因为催化剂改变了反应历程,使活化能E降低 > 温度 >
【解析】(1)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10molL-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10molL-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L;②当Qc=Ksp(FeS)时开始沉淀,所以c(S2-)=Ksp(FeS)/c(Fe2+)
=1.4×1019/0.01mol/L=1.4×10-17mol/L,结合图象得出此时的pH=2,所以pH=2时亚铁离子开始沉淀;溶液中c(Mn2+)/c(Fe2+)=Ksp(MnS)/Ksp(FeS)=2.8×1013/1.4×1019mol/L=2×106;(2)SO2(g)+1/2O2(g)SO3(g)△H=-99kJ/mol, ①图象分析可知2molSO2和氧气全部反应,反应焓变△H=-99kJ/mol×2mol=-198kJ;E为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关;加入催化剂改变了反应的途径,降低反应所需的活化能,所以E的变化是减小;②该温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),浓度分别是(mol/L)0.03、0.16、0.03,浓度商Qc=0.03/0.03×0.161/2=2.5<3.33,则反应开始时(正)>v(逆);③由图可知,X越大,转化率越低,该反应正反应为气体体积减小的反应,如果增大压强,二氧化碳的转化率大,所以X表示温度,温度升高,转化率下降,平衡逆向移动,增大压强,转化率大,所以L1>L2。