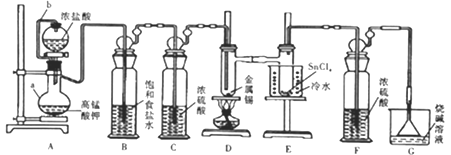
题目内容
【题目】将4.74gK2SO4·Al2(SO4)3·nH2O的样品溶于水,配制成250ml溶液,取出20ml溶液,与浓度为0.064mol/L的氯化钡溶液25ml恰好完全反应生成沉淀.则K+的物质的量浓度为多少? n值为多少?
__________________、____________________
【答案】 C(K+)=0.04mol/L n=24
【解析】25ml 0.064mol/L的氯化钡溶液中含有n(Ba2+)= 0.064mol/L×0.025L=0.0016mol,则反应的n(SO42-)=0.0016mol,因此4.74gK2SO4·Al2(SO4)3·nH2O的样品中n(SO42-)=0.0016mol×![]() =0.02mol,因此K2SO4·Al2(SO4)3·nH2O的物质的量为0.005mol,M[K2SO4·Al2(SO4)3·nH2O]=
=0.02mol,因此K2SO4·Al2(SO4)3·nH2O的物质的量为0.005mol,M[K2SO4·Al2(SO4)3·nH2O]= ![]() =948g/mol,因此n=
=948g/mol,因此n=![]() =24,
=24,
c(K+)=![]() =0.04 mol/L,故答案为:c(K+)=0.04 mol/L;n=24。
=0.04 mol/L,故答案为:c(K+)=0.04 mol/L;n=24。

【题目】I.下表是A、B两种有机物的有关信息:
A | B |
①分子填充模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是__________(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2CH2
(2)A与氢气发生加成反应后生成物质C,与C在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=__________时,这类有机物开始出现同分异构体。
(3)B与乙醇反应的化学方程式为 ____________________,反应类型为____________________。
(4)以A为原料可直接生产一种高分子化合物,该高分子化合物的结构简式为__________。
II.糖类、油脂和蛋白质是人体需要的重要营养素。
(5)下列说法正确的是__________(填标号)。
a.糖类、油脂、蛋白质都是仅由C、H、O三种元素组成的
b.糖类、油脂、蛋白质都是高分子化合物
c.油脂有油和脂肪之分,都属于酯
(6)淀粉和纤维素的化学式都是(C6H10O5)n,它们__________(选“是,,或“不是”)同分异构体,淀粉水解的最终产物是__________(写名称)。
(7)重金属盐能使人体中毒,这是由于它使人体内的蛋白质发生了__________(选“盐析”或“变性”)作用。
【题目】图表法、图像法是常用的科学研究方法。
下表列出原子序数依次增大的短周期元素中四种元素性质的一些数据:
性质 元素 | A | B | C | D |
原子半径(10-10 m) | 0.37 | 0.77 | 0.74 | 0.99 |
最高价态 | +1 | +4 | - | +7 |
最低价态 | -1 | -4 | -2 | -1 |
用所给元素试回答下列问题:
(1)比元素A原子序数大28的元素,其基态原子的核外电子排布式为___________。
(2)元素A、B、C可形成一种相对分子质量为60的一元羧酸分子,则一个该分子中共含有________个σ键,________个π键。
(3)如图是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第________族元素氢化物的沸点的变化规律。(2分)
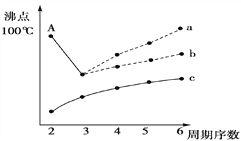
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是________,理由是__________________________________(2分)。
【题目】常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
试验编号 | HX的物质的量浓度(mol/L) | NaOH的物质的量浓度(mol/L) | 混合溶液的PH |
甲 | 0.2 | 0.2 | PH=a |
乙 | c1 | 0.2 | PH=7 |
丙 | 0.2 | 0.2 | PH>7 |
丁 | c2 | c3 | PH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a________7(填“>”“<”或“=”),则HX为强酸;若a________7(填“>”“<”或“=”),则HX为弱酸.
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是________.
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)丙溶液中离子浓度由大到小的顺序是_____________________________.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L.