题目内容
根据下列实验装置及现象,可以得到相应结论的是( )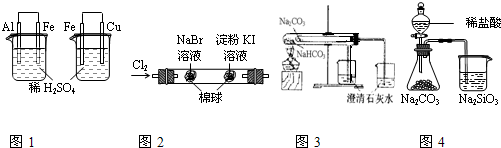

| 实验现象 | 结论 | |
| A | 图1左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 图2左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 图3左边烧杯变浑浊,右边烧杯不变浑浊 | 热稳定性:Na2CO3>NaHCO3 |
| D | 图4锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
分析:A.金属与酸形成的原电池中,负极金属较活泼;
B.氯气与KI反应生成碘;
C.比较稳定性,碳酸氢钠应在小试管中;
D.盐酸易挥发,盐酸与硅酸钠溶液反应生成硅酸.
B.氯气与KI反应生成碘;
C.比较稳定性,碳酸氢钠应在小试管中;
D.盐酸易挥发,盐酸与硅酸钠溶液反应生成硅酸.
解答:解:A.图1左烧杯中形成的原电池铝作负极,铁作正极,活动性Al>Fe,右烧杯中形成的原电池铁作负极,铜作正极,活动性Fe>Cu,故A正确;
B.图2可能是过量的氯气将KI氧化,该项不能证明氧化性Br2>I2,故B错误;
C.图3中Na2CO3应放在大试管中,NaHCO3应放在小试管中,故C错误;
D.图4所用稀盐酸不是氯元素的最高价氧化物的水化物,且盐酸易挥发,盐酸与硅酸钠溶液反应生成硅酸,不能比较非金属性,故D错误;
故选A.
B.图2可能是过量的氯气将KI氧化,该项不能证明氧化性Br2>I2,故B错误;
C.图3中Na2CO3应放在大试管中,NaHCO3应放在小试管中,故C错误;
D.图4所用稀盐酸不是氯元素的最高价氧化物的水化物,且盐酸易挥发,盐酸与硅酸钠溶液反应生成硅酸,不能比较非金属性,故D错误;
故选A.
点评:本题考查化学实验方案的评价,综合性较强,考查知识点较多,本题实际是从物质的性质、实验装置、实验原理等方面对实验进行评价,侧重原电池、元素性质的比较、氧化还原反应等的考查,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.(1)提出问题:Fe3+、Br2的氧化性哪个更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象是因为溶液中含
②乙同学认为氧化性:Fe3+<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
(3)设计实验并验证,丙同学为验证乙同学的观点,选用下列某些试剂,设计了两种方案进行实验.通过观察实验现象,证明乙同学的观点是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
| 编号 | 选用试剂 | 实验现象 |
| 方案1 | ||
| 方案2 |
氧化性:Fe3+<Br2.写出在足量的稀氯化亚铁溶液中加入1~2滴溴水的离子反应方程式
(5)结论应用
在2mol FeBr2溶液中通入一定量的Cl2,当有33.6L Cl2(标准状况)与FeBr2溶液发生反应时,所发生的离子反应方程式为
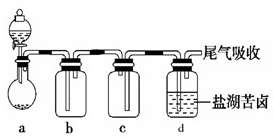
(6)某同学用图所示的实验装置制取氧化剂Cl2并将其通入盐湖苦卤中.装置c在实验中的作用是
A.制NH3:浓氨水和碱石灰
B.制SO2:Cu片和浓硫酸
C.制NO:Cu片和稀硝酸
D.制O2:MnO2和双氧水.


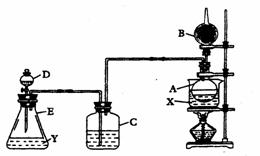 Ⅰ.装置中所装的试剂是:①A瓶装无水乙醇,内放无水盐X;②B干燥管里装生石灰;
Ⅰ.装置中所装的试剂是:①A瓶装无水乙醇,内放无水盐X;②B干燥管里装生石灰;