题目内容
【研究课题】探究乙二酸的某些性质
【查阅资料】乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
| 名称 | 乙二酸 | 乙二酸晶体 |
| 分子式 | H2C2O4 | H2C2O4?2H2O |
| 颜色状态 | 无色固体 | 无色晶体 |
| 溶解度(g) | 8.6(20℃) | - |
| 熔点(℃) | 189.5 | 101.5 |
| 密度(g?cm-3) | 1.900 | 1.650 |
①草酸在100℃时开始升华,157℃时大量升华,并开始分解.
②草酸钙不溶于水.
③草酸蒸气能使澄清石灰水变浑浊.
④草酸蒸气在低温下可冷凝为固体.
根据上述材料提供的信息,回答下列问题:
【提出猜想】
(猜想一)根据草酸晶体的组成对其分解产物进行猜想
设计方案:
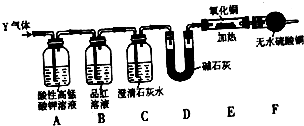
(1)该小组同学猜想其产物为CO、CO2和H2O,请用下列装置组成一套探究实验装置(草酸晶体分解装置略,装置可重复使用,连接导管略去).
A中水槽装冰水混合物、B中装氧化铜、C中装无水硫酸铜,D中装澄清石灰水、E中装碱石灰
请回答下列问题:
①装置的连接顺序为:A→
②检验产物中CO的实验现象是
③整套装置是否存在不合理之处,
(猜想二)乙二酸具有弱酸性
设计方案:
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定相同浓度的草酸和硫酸溶液的pH
C.测定草酸钠(Na2C2O4)溶液的pH
D.将草酸溶液加入Na2CO3溶液中,有CO2放出
(猜想三)乙二酸具有还原性
设计方案:
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性.配平该反应的离子方程式:
(4)利用上述原理可定量测定某草酸晶体样品(含有H2C2O4?2H2O及其它一些杂质)中H2C2O4?2H2O的含量.
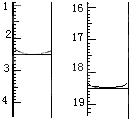
方法是:称取该样品0.12g,加适量水完全溶解,然后用0.020mol?L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示(单位:mL),则该草酸晶体样品中H2C2O4?2H2O的质量分数为
②检验产物中CO的实验现象是C中黑色氧化铜变红色,生成了澄清石灰水变浑浊的气体;
③装置存在缺陷,一氧化碳有毒污染空气,需要吸收处理装置;
(2)证明草酸具有弱酸性需要证明草酸溶液中 存在电离平衡;
(3)依据氧化还原反应元素化合价变化和电子守恒、原子守恒配平得到反应的离子方程式;
(4)依据高锰酸钾和草酸反应的定量关系,结合消耗高锰酸钾溶液的体积和浓度计算物质的量,得到草酸物质的量,计算样品中的含量;
故答案为:A→C→D→E→B→D;
②检验产物中CO的实验现象是,一氧化碳还原C中黑色氧化铜变为红色的铜,同时生成了使澄清石灰水变浑浊的气体二氧化碳;
故答案为:黑色固体变成红色,且澄清石灰水变浑浊;
③装置存在缺陷,一氧化碳有毒污染空气,需要吸收处理装置,一氧化碳尾气的处理方法为点燃,操作时将气体通到酒精灯火焰上燃烧;
故答案为:是,无尾气处理装置,将尾气通到燃着的酒精灯上;
(2)A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,只能说明酸碱反应,不能说明草酸是弱酸,故A不符合;
B.草酸和硫酸都是二元酸,测定相同浓度的草酸和硫酸溶液的pH,若不同PH大的为草酸证明存在电离平衡,故B符合;
C.测定草酸钠(Na2C2O4)溶液的pH,若显碱性,证明草酸根离子水解,证明草酸是弱酸,故C符合;
D.将草酸溶液加入Na2CO3溶液中,有CO2放出,只能说明草酸酸性大于碳酸,但不能证明草酸是弱酸,故D不符合;
故选BC.
(3)根据氧化还原反应方程式的配平原则:锰元素化合价+7价变化为+2价,电子转移5,草酸中碳元素化合价+3价变化为+4价,得失电子守恒、质量守恒和电荷守恒配平该反应的离子方程式,:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
故答案为:2、5、6、2、10、8;
(4)滴定管读数为开始是2.50ml,滴定后18.50ml,消耗高锰酸钾溶液体积为:18.50ml-2.5ml=16.00ml;
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
2 5
0.020mol?L-1×0.0160L 0.0008mol
该草酸晶体样品中H2C2O4?2H2O的质量分数=
| 0.0008mol×126g/mol |
| 0.12g |
故答案为:84.0%;

(11分)以下是某学习小组对乙二酸的某些性质进行研究性学习的过程:
[研究课题]探究乙二酸的某些性质
[查阅资料]乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
| 名称 | 乙二酸 | 乙二酸晶体 |
| 分子式 | H2C2O4 | H2C2O4·2H2O |
| 颜色状态 | 无色固体 | 无色晶体 |
| 溶解度(g) | 8.6(20℃) | — |
| 熔点(℃) | 189.5 | 101.5 |
| 密度(g·cm-3) | 1.900 | 1.650 |
草酸在100℃时开始升华,157℃时大量升华,并开始分解。
草酸钙不溶于水。
草酸蒸气能使澄清石灰水变浑浊。
草酸蒸气在低温下可冷凝为固体。
根据上述材料提供的信息,回答下列问题:
[提出猜想]
(猜想一)根据草酸晶体的组成对其分解产物进行猜想
设计方案:
(1)该小组同学猜想其产物为CO、CO2和H2O,请用下列装置组成一套探究实验装置(草酸晶体分解装置略,装置可重复使用,连接导管略去)。

A中水槽装冰水混合物、B中装氧化铜、C中装无水硫酸铜,D中装澄清石灰水、E中装碱石灰
请回答下列问题:
①装置的连接顺序为:A→_____________________________________________。
②检验产物中CO的实验现象是____________________________________________________________
③整套装置是否存在不合理之处, (填是或否),若有该如何解决___________________________________________________________________________
(猜想二)乙二酸具有弱酸性
设计方案:
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是______(填字母)。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定相同浓度的草酸和硫酸溶液的pH
C.测定草酸钠(Na2C2O4)溶液的pH
D.将草酸溶液加入Na2CO3溶液中,有CO2放出
(猜想三)乙二酸具有还原性
设计方案:
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。配平该反应的离子方程式:
___MnO4-+___H2C2O4 +___H+ ===___Mn2+ +___CO2↑+___H2O
(4)利用上述原理可定量测定某草酸晶体样品(含有H2C2O4·2H2O及其它一些杂质)中H2C2O4·2H2O的含量。
方法是:称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1
的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示(单位:mL),则该草酸晶体样品中H2C2O4·2H2O的质量分数为_____________。
(已知相对原子质量:Mr(H2C2O4·2H2O)=126)

(11分)以下是某学习小组对乙二酸的某些性质进行研究性学习的过程:
[研究课题]探究乙二酸的某些性质
[查阅资料]乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
|
名称 |
乙二酸 |
乙二酸晶体 |
|
分子式 |
H2C2O4 |
H2C2O4·2H2O |
|
颜色状态 |
无色固体 |
无色晶体 |
|
溶解度(g) |
8.6(20℃) |
— |
|
熔点(℃) |
189.5 |
101.5 |
|
密度(g·cm-3) |
1.900 |
1.650 |
又知:
草酸在100℃时开始升华,157℃时大量升华,并开始分解。
草酸钙不溶于水。
草酸蒸气能使澄清石灰水变浑浊。
草酸蒸气在低温下可冷凝为固体。
根据上述材料提供的信息,回答下列问题:
[提出猜想]
(猜想一)根据草酸晶体的组成对其分解产物进行猜想
设计方案:
(1)该小组同学猜想其产物为CO、CO2和H2O,请用下列装置组成一套探究实验装置(草酸晶体分解装置略,装置可重复使用,连接导管略去)。

A中水槽装冰水混合物、B中装氧化铜、C中装无水硫酸铜,D中装澄清石灰水、E中装碱石灰
请回答下列问题:
① 装置的连接顺序为:A→_____________________________________________。
② 检验产物中CO的实验现象是____________________________________________________________
③ 整套装置是否存在不合理之处, (填是或否),若有该如何解决___________________________________________________________________________
(猜想二)乙二酸具有弱酸性
设计方案:
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是______(填字母)。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定相同浓度的草酸和硫酸溶液的pH
C.测定草酸钠(Na2C2O4)溶液的pH
D.将草酸溶液加入Na2CO3溶液中,有CO2放出
(猜想三)乙二酸具有还原性
设计方案:
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。配平该反应的离子方程式:
___MnO4-+___H2C2O4 +___H+ ===___Mn2+ +___CO2↑+___H2O
(4)利用上述原理可定量测定某草酸晶体样品(含有H2C2O4·2H2O及其它一些杂质)中H2C2O4·2H2O的含量。
方法是:称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1
的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示(单位:mL),则该草酸晶体样品中H2C2O4·2H2O的质量分数为_____________。
(已知相对原子质量:Mr(H2C2O4·2H2O) =126)
=126)

 (2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.
(2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.