题目内容
18.物质分类对研究物质性质有指导意义,下列相关说法错误的是( )| A. | 金属单质可能与非金属、酸、盐溶液发生反应 | |
| B. | 酸性氧化物能与碱反应且大部分能与水化合成酸 | |
| C. | 碱性氧化物能与酸反应且都能与水化合成碱 | |
| D. | 酸能与金属、碱性氧化物、碱、某些盐溶液发生反应 |
分析 A.铁能与氯气、盐酸、硫酸铜溶液反应;
B.酸性氧化物和碱反应生成盐和水;
C.碱性氧化物不一定都和水反应生成碱;
D.盐酸与铁、氧化钠、氢氧化钠和碳酸钠反应.
解答 解:A.金属单质可能与非金属、酸、盐溶液发生反应,如铁能与氯气、盐酸、硫酸铜溶液反应,故A正确;
B.酸性氧化物和碱反应生成盐和水,大部分能与水化合成酸,如二氧化碳能与水反应生成碳酸,故B正确;
C.碱性氧化物不一定都和水反应生成碱,如Fe2O3是碱性氧化物但不与水反应,故C错误;
D.酸能与金属、碱性氧化物、碱、某些盐溶液发生反应,盐酸与铁、氧化钠、氢氧化钠和碳酸钠反应,故D正确.
故选C.
点评 本题考查了酸碱盐、氧化物的概念及其联系,难度不大,但概念间的联系是学习的难点,属于易错题.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
9.下列有关实验原理、方法和结论都正确的是( )
| A. | 滴加盐酸酸化的BaCl2溶液,生成白色沉淀,原溶液中一定含有SO42- | |
| B. | 将钾盐溶于盐酸,产生能使澄清石灰水变浑浊的气体,该钾盐一定为K2C03 | |
| C. | 某固体进行焰色反应实验,火焰呈黄色,说明该固体为钠盐 | |
| D. | 向某溶液中滴加KSCN溶液,不变色,再滴加氯水显红色,则 溶液中一定含有Fe2+ |
6.现有以下两种有机物:① ②
② ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ②
② ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 有机物①分子中所有原子不可能在同一平面上 | |
| B. | 有机物②与硝基乙烷(CH3CH2NO2)互为同分异构体 | |
| C. | 有机物①与②的核磁共振氢谱具有相同数目的吸收峰 | |
| D. | 有机物①能与浓溴水发生加成反应和取代反应 |
13.下列实验方案可行的是( )
| A. | 用溶解、过滤的方法分离碳酸钙固体和氯化钠固体 | |
| B. | 用乙醇萃取碘水中的碘 | |
| C. | 用蒸馏的方法从NaCl溶液中分离出溶质 | |
| D. | 用分液的方法分离植物油和水 |
3.已知10.2g A与12.8g B完全反应,生成9.6g C和7.2g D及另一气体E,已知E的密度是H2密度的15.5倍.则气体E在标准状况下的体积( )
| A. | 2.24L | B. | 4.48L | C. | 5.6L | D. | 11.2L |
14.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.2Fe3++2I-═2Fe2++I2 I2+2S2O3═2I-+S4O62-已知:
则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.2Fe3++2I-═2Fe2++I2 I2+2S2O3═2I-+S4O62-已知:
则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)
15.下列试剂中可用于鉴别Fe2+和Fe3+的是( )
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
| A. | ①③ | B. | ①②③ | C. | ①③④ | D. | ①②③④ |
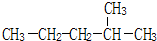 2-甲基戊烷
2-甲基戊烷 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯 1,2-二溴乙烷
1,2-二溴乙烷 乙苯
乙苯


