��Ŀ����
����Ŀ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���壮
��1��Wԭ�ӵĺ�������Ų�ʽΪ ��
��2������X��Y��Z����Ԫ����ɵ����ֳ�������A��B��C�ֱ������ᡢ��Σ������εĻ�ѧʽΪ �� �Ʋ����������ӵĿռ乹��Ϊ �� ������ԭ���ӻ���ʽΪ ��
��3��Z��W����Ԫ�ص縺�ԵĴ�С��ϵΪ��Y��Z����Ԫ�ص�һ�����ܵĴ�С��ϵΪ ��
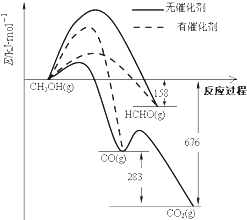
��4��CO�Ľṹ�ɱ�ʾΪCO��Ԫ��Y�ĵ���Y2�ĽṹҲ�ɱ�ʾΪYY����������ߵļ������ݣ���λ��kJmol��1����
A��B | A�TB | A��B | |
CO | 357.7 | 798.9 | 1071.9 |
Y2 | 154.8 | 418.4 | 941.7 |
�ٽ������˵��CO��Y2���õ�ԭ�� ��
�������������ѧFulvio Cacace���˻���˼����о������Y4���ӣ���ṹ��ͼ��ʾ�������ϱ����ݷ���������˵���У���ȷ���� ��
A��Y4Ϊһ�����ͻ�����
B��Y4��Y2��Ϊͬ��������
C��Y4�ķе��P4�����ף���
D.1mol Y4����ת��ΪY2���ų�954.6kJ������
���𰸡�
��1��1s22s22p63s23p4
��2��NH4NO3,ƽ��������,sp2
��3��O��S,N��O
��4��CO�ĵ�һ���м��ļ���Ϊ273kJ/mol,N2�еĵ�һ���м��ļ���Ϊ523.3kJ/mol,����CO�ĵ�һ������N2��������,B
���������⣺ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ���X��HԪ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���壬��Y��ԭ��������a����Z��ԭ��������a+1��Wԭ��������a+9��a+a+1+a+9+1=32����a=7������Y��N��Z��O��W��SԪ�أ���1��W��SԪ�أ���ԭ�Ӻ�����16�����ӣ����ݹ���ԭ��֪���̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p4�����Դ��ǣ�1s22s22p63s23p4����2������H��N��O����Ԫ����ɵ����ֳ�������A��B��C�ֱ������ᡢ��Σ��������ᡢ����һˮ�ϰ�����������泥��εĻ�ѧʽΪNH4NO3����������Ӽ۲���ӶԸ���=3+ ![]() ��5+1��3��2��=3�Ҳ����µ��Ӷԣ�������������ӿռ�ṹΪƽ�������Σ�Nԭ���ӻ���ʽΪSP2�����Դ��ǣ�NH4NO3��ƽ�������Σ�SP2����3��ͬһ����Ԫ���У�Ԫ�صĵ縺������ԭ���������������С�����Ե縺��O��S��
��5+1��3��2��=3�Ҳ����µ��Ӷԣ�������������ӿռ�ṹΪƽ�������Σ�Nԭ���ӻ���ʽΪSP2�����Դ��ǣ�NH4NO3��ƽ�������Σ�SP2����3��ͬһ����Ԫ���У�Ԫ�صĵ縺������ԭ���������������С�����Ե縺��O��S��
ͬһ����Ԫ���У�Ԫ�صĵ�һ����������ԭ����������������������ƣ�����VA��Ԫ�ص�һ�����ܴ�������Ԫ�أ����Ե�һ������N��O��
���Դ��ǣ�O��S��N��O����4���ٸ��ݱ������ݿ�֪������C��O�е�һ���м����ĵ�������1071.9kJ/mol��798.9kJ/mol=273kJ/mol������N��N�е�һ���м����ĵ�������941.7kJ/mol��418.4kJ/mol=523.3kJ/mol������һ���м�CO��N2�����ף�����CO�����ã�
���Դ��ǣ�CO�ĵ�һ���м��ļ���Ϊ273kJ/mol��N2�еĵ�һ���м��ļ���Ϊ523.3kJ/mol������CO�ĵ�һ������N2�������ѣ�
��A��N4Ϊ���ʲ��ǻ������A����
B��N4��N2Ϊͬ��Ԫ�صIJ�ͬ���£���Ϊͬ�������壬��B��ȷ��
C��N4��P4���Ƿ��Ӿ��壬���ҽṹ���ƣ���Է�������Խ���Ӽ�������Խǿ���е�Խ�ߣ������ķе�ߣ���C����
D.1molN4�����к���6molN��N����������2molN2���γ�2molN��N������1molN4����ת��ΪN2��ѧ�����Ѷ������յ�����Ϊ6��154.8KJ=928.8KJ���γɻ�ѧ���ų�������Ϊ941.7KJ��2=1883.4kJ������1molN4����ת��ΪN2�����ȣ���ų�������=1883.4kJ��928.8KJ=924.6kJ����D����
��ѡB��

����Ŀ�����У� ![]() ����һ����Ҫ���л��ϳ��м��壬ʵ���ҿ��ñ���1��2һ�������飨ClCH2CH2Cl��Ϊԭ�ϣ�����ˮAlCl3���¼����Ƶã�����ȡ����Ϊ��
����һ����Ҫ���л��ϳ��м��壬ʵ���ҿ��ñ���1��2һ�������飨ClCH2CH2Cl��Ϊԭ�ϣ�����ˮAlCl3���¼����Ƶã�����ȡ����Ϊ��
��1���������Ʊ���ͼ1��ʵ������ȡ������ˮAlCl3�����ʵ��װ�õ�������ҩƷ�� 
�ٽ������������ӳ�һ���Ʊ���������ˮAlCl3��װ�ã����ܿڱ������˳��Ϊ��d��e���� �� �� �� �� ��
�����˽��齫����װ����Dȥ��������װ�ú��Լ����䣬Ҳ���Ʊ���ˮAlCl3 �� ����Ϊ�������Ƿ����������С������С�������������� ��
��װ��A��������һ�ְ�ȫ�����������һ�ָĽ������� ��
��2�����е��Ʊ� ���е���ȡԭ��Ϊ�� ![]()
��Ӧ�������Ϊn��������n��1��2���������飩=10��1����Ӧ�¶���60��65��֮�䣮ʵ������ȡ���е�װ����ͼ2��ʾ�����Ⱥͼӳ�������ȥ����
ʵ�鲽�裺
��������ƿ�м���120.0mL����������ˮAlCl3 �� �ɵ�Һ©���μ�10.7mL1��2���������飬���Ʒ�Ӧ�¶���60��65�棬��ӦԼ60min������Ӧ��Ļ����������ϡ���ᡢ2%Na2CO3��Һ��H2Oϴ�ӷ��룬�����ò����м���������ˮMgSO4���壬��ֹ�����ˣ��ȳ�ѹ�����ټ�ѹ�����ռ�170��172�����֣�������18.2g��
������������������������±�
���� | ��Է������� | �ܶ�/��gcm��3�� | �۵�/�� | �е�/�� | �ܽ��� |
�� | 78 | 0.88 | 5.5 | 80.1 | ����ˮ�������Ҵ� |
1��2һ�������� | 99 | 1.27 | ��35.3 | 83.5 | ����ˮ�����ܱ� |
��ˮ�Ȼ��� | 133.5 | 2.44 | 190 | 178�������� | ��ˮˮ�⣬�ܱ� |
���� | 182 | 0.98 | 52 | 284 | ����ˮ�����ܱ� |
������a������Ϊ �� ����ͨ��Һ©����ȣ�ʹ�õ�Һ©�����ŵ��� ��
��ϴ�Ӳ����У�ˮϴ��Ŀ��������ˮ����þ�������� ��
��ѹ����ʱ����Ϳ����¶��� ��
�߸�ʵ��IJ���ԼΪ �� ��С���������λ��Ч���֣�
����Ŀ���Ȼ���ͭ��CuCl���������л��ϳɹ�ҵ�еĴ������ڿ�����Ѹ�ٱ���������ɫ��������ֽ⣬��ɺ�ɫ����ͼ�ǹ�ҵ��������ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl��������CuCl�����̣� 
����������Ϣ�ش��������⣺
��1������������X�Ļ�ѧʽΪ ��
��2��д������CuCl�Ļ�ѧ����ʽ�� ��
��3����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��ϻ�ѧ����ʽ�ͱ�Ҫ������˵������ �� ʵ��������SO2Ҫ�ʵ�������ԭ�����������һ�㼴�ɣ���
��4��ʵ��̽��pH��CuCl���ʵ�Ӱ�����±���ʾ��
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl����/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
����CuCl�������pHΪ �� ��pH�ϴ�ʱCuCl���ʱ��ԭ���� �� ����pHʱ������ܡ����ܡ�������ͬpH������������ᣬ������ ��
��5���Ȼ���ͭ�Ķ��������� �ٳ�ȡ��Ʒ0.25g������FeCl3��Һ����ƿ�У�����ܽ⣮
����0.10molL��1���������Һ�ζ�����֪��CuCl+FeCl3�TCuCl2+FeCl2��Fe2++Ce4+�TFe3++Ce3+ �� ����ƽ��ʵ�������£�ƽ��ʵ�������ܳ���1%����
ƽ��ʵ����� | 1 | 2 | 3 |
0.25g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 |
����Ʒ��CuCl�Ĵ���Ϊ�����������λ��Ч���֣���