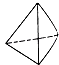
题目内容
【题目】下列各溶液中,一定能大量共存的是( )
A.Fe2+、Na+、SO42﹣、H2O2
B.SO32﹣、MnO4﹣、H+、K+
C.Pb2+、K+、SO42﹣、Cl﹣
D.Na+、SO32﹣、K+、SO42﹣
【答案】D
【解析】解:A.Fe2+、H2O2发生氧化还原反应,不能共存,故A不选; B.SO32﹣、MnO4﹣、H+发生氧化还原反应,不能共存,故B不选;
C.Pb2+、SO42﹣结合生成沉淀,不能共存,故C不选;
D.该组离子之间不反应,可大量共存,故D选;
故选D.

【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO47H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间) 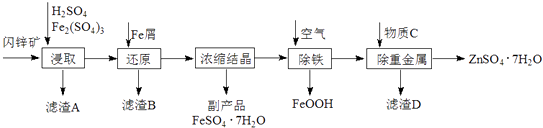
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 .
(2)浸取过程中Fe2(SO4)3的作用是 , 浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 .
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 . 该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 .
(4)置换法除重金属离子是Cd2+ , 所用物质C为 .
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、过滤、干燥.
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)W原子的核外电子排布式为 .
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其中盐的化学式为 , 推测盐中阴离子的空间构型为 , 其中心原子杂化方式为 .
(3)Z、W两种元素电负性的大小关系为;Y、Z两种元素第一电离能的大小关系为 .
(4)CO的结构可表示为CO,元素Y的单质Y2的结构也可表示为YY.如表是两者的键能数据(单位:kJmol﹣1):
A﹣B | A═B | A≡B | |
CO | 357.7 | 798.9 | 1071.9 |
Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明CO比Y2活泼的原因: .
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是 .
A.Y4为一种新型化合物
B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高
D.1mol Y4气体转变为Y2将放出954.6kJ热量.