题目内容
【题目】人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]. 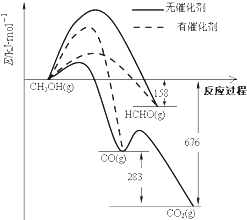
①在有催化剂作用下,CH3OH与O2反应主要生成(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H= .
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: .
【答案】HCHO;﹣470kJ?mol﹣1; AgCl+2NH3?H2O=Ag(NH3)2++Cl﹣+2H2O或AgCl+2NH3=Ag(NH3)2++Cl﹣
【解析】解:(1)①根据图象可以看出转化成甲醛时活化能最低,使用催化剂时主要产物为HCHO;
2HCHO(g)+O2(g)═2CO(g)+2H2O(g)该反应为放热反应,△H=﹣2(676﹣158﹣283)KJmol﹣1=﹣470KJmol﹣1;
所以答案是:HCHO;﹣470KJmol﹣1;
②氯化银与氨水发生络合反应的离子方程式:AgCl+2NH3H2O=Ag(NH3)2++Cl﹣+2H2O或者AgCl+2NH3=Ag(NH3)2++Cl﹣,
所以答案是:AgCl+2NH3H2O=Ag(NH3)2++Cl﹣+2H2O或AgCl+2NH3=Ag(NH3)2++Cl﹣.
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热).

【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)W原子的核外电子排布式为 .
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其中盐的化学式为 , 推测盐中阴离子的空间构型为 , 其中心原子杂化方式为 .
(3)Z、W两种元素电负性的大小关系为;Y、Z两种元素第一电离能的大小关系为 .
(4)CO的结构可表示为CO,元素Y的单质Y2的结构也可表示为YY.如表是两者的键能数据(单位:kJmol﹣1):
A﹣B | A═B | A≡B | |
CO | 357.7 | 798.9 | 1071.9 |
Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明CO比Y2活泼的原因: .
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是 .
A.Y4为一种新型化合物
B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高
D.1mol Y4气体转变为Y2将放出954.6kJ热量.


