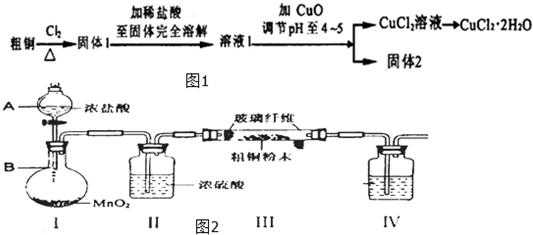
题目内容
6.温度t℃时,某NaOH稀溶液中c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12,请回答下列问题(1)该温度下水的离子积常数KW=10-12mol2/L2.
(2)该NaOH溶液中NaOH的物质的量浓度为10-bmol/L,该NaOH溶液中由水电离出的c(OH-)为10-amol/L.
(3)给该NaOH溶液加热,pH变小(填“变大”,“变小”或“不变”).
(4)该温度下若a=8,要中和该NaOH溶液500mL,需pH=2的盐酸溶液的体积为5mL.
分析 (1)溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;
(2)该NaOH溶液中NaOH的物质的量浓度为C(NaOH)=c(OH-)=10-bmol/L;依据溶液中的离子积Kw=C(H+)×c(OH-)=10-12;该NaOH溶液中由水电离出的c(OH-)为10-a;
(3)给该NaOH溶液加热,促进水的电离,溶液中存在离子积常数,离子积常数增大,溶液中氢氧根离子浓度是碱的氢氧根离子浓度不变,氢离子浓度增大,所以溶液PH减小;
(4)根据酸和碱的物质的量相等计算.
解答 解:(1)溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;故答案为:10-12mol2/L2;
(2)该NaOH溶液中NaOH的物质的量浓度为C(NaOH)=c(OH-)=10-bmol/L;依据溶液中的离子积Kw=C(H+)×c(OH-)=10-12;该NaOH溶液中由水电离出的c(OH-)为10-a;
故答案为:10-bmol/L;10-amol/L;
(3)给该NaOH溶液加热,促进水的电离,溶液中存在离子积常数,离子积常数增大,溶液中氢氧根离子浓度是碱的氢氧根离子浓度不变,氢离子浓度增大,所以溶液PH减小;
故答案为:变小;
(4)完全中和时,酸和碱的物质的量相等,a=8,则氢氧化钠的物质的量浓度为0.0001mol/L,中和该NaOH溶液500mL,需pH=2的盐酸溶液体积=$\frac{0.0001mol/L×0.5L}{0.01mol/L}$=5mL,
故答案为:5mL.
点评 本题考查了水溶液中的离子积常数应用,溶液PH计算应用,关键是离子积常数随温度变化,题目较简单.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
17.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | Al、Fe、Cu三者的单质放置在空气中均只生成氧化物 | |
| C. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| D. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
1.下列说法中正确的是( )
| A. | 某酸性溶液中,HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、Na+可大量共存 | |
| B. | NA表示阿伏加德罗常数,则常温常压下,3.0g乙烷中含有的碳氢键数为0.6NA | |
| C. | 实验室中,常用玻璃瓶盛放氢氟酸 | |
| D. | 用饱和NaHCO3溶液可除去CO2中的HCl气体 |
6.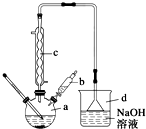 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)仪器a的名称是三颈烧瓶.
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
7.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向NH4Al(S04)2溶液中滴加过量Ba(OH)2溶液:2Ba2++40H-+2S042-+Al3+=2BaS04↓+2H20+Al02- | |
| B. | 向NaHS04溶液中滴Ba(OH)2溶液至S042-完全沉淀:2 H++S042-+Ba2++20H-=BaS04↓+2H20 | |
| C. | 向0.1mol.L-l、pH=l的NaHA溶液中加入NaOH溶液:HA-十OH-=A2-+H20 | |
| D. | 向1L lmol.L-1的FeBr2溶液中通等物质的量Cl2:2Cl2+2Fe2++2Br-=4Cl-十2Fe3++Br2 |
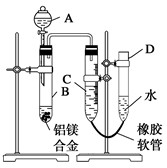 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.