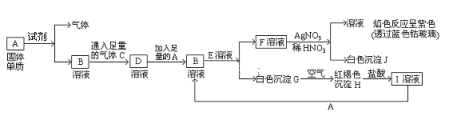
题目内容
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4一,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是
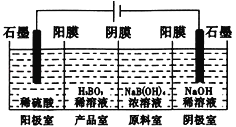
A. 当电路中通过1mol电子时,可得到lmolH3BO3
B. 将电源的正负极反接,工作原理不变
C. 阴极室的电极反应式为:2H2O-4e-=O2+4H+
D. B(OH)4一穿过阴膜进入阴极室,Na+穿过阳膜进入产品室
【答案】A
【解析】
阳极电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为4H2O+4e-=2H2↑+4OH-,阳极室中的氢离子通入阳膜进入产品室,B(OH)4一穿过阴膜进入产品室,发生反应:B(OH)4一+H+=H2O+H3BO3,据此判断。
A.阳极发生失去电子的氧化反应,电极反应式为2H2O-4e-=O2↑+4H+,电路中通过1mol电子时有1molH+生成,硼酸(H3BO3)为一元弱酸,生成1mol硼酸需要1molH+,所以电路中通过1mol电子时,可得到1molH3BO3,A正确;
B.根据以上分析可知如果将电源的正负极反接,工作原理发生变化,B错误;
C.电解时阴极发生得到电子的还原反应,电极反应式为4H2O+4e-=2H2↑+4OH-,C错误;
D.阳极电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为4H2O+4e-=2H2↑+4OH-,阳极室中的氢离子通入阳膜进入产品室,B(OH)4一穿过阴膜进入产品室,发生反应:B(OH)4一+H+=H2O+H3BO3,Na+穿过阳膜进入阴极室,D错误;
答案选A。

【题目】一定温度下,10ml 0.40mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6min的平均反应速率: v(H2O2)≈3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率: v(H2O2)<3.3×10-2mol/(L·min)
C. 反应至6min时, c(H2O2)=0.30mol·L-1
D. 反应至6min时,H2O2分解了50%
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
【题目】下列各组物质之间不能通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| SiO2 | Na2SiO3 | Si | H2SiO3 |
B | Na2O | Na2O2 | Na | NaOH | |
C | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
D | FeCl2 | FeCl3 | Fe | CuCl2 |
A. A B. B C. C D. D