题目内容
【题目】一定温度下,10ml 0.40mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6min的平均反应速率: v(H2O2)≈3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率: v(H2O2)<3.3×10-2mol/(L·min)
C. 反应至6min时, c(H2O2)=0.30mol·L-1
D. 反应至6min时,H2O2分解了50%
【答案】C
【解析】A、0-6min时产生氧气体积为22.4mL,则消耗H2O2的物质的量为22.4×10-3×2/22.4mol=2×10-3mol,根据化学反应速率,v(H2O2)= 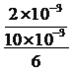 mol/(L·min)≈3.3×10-2 mol/(L·min),故A说法正确;B、随着反应进行,过氧化氢的浓度降低,化学反应速率降低,即6-10min的平均反应速率v(H2O2)< 3.3×10-2 mol/(L·min),故B说法正确;C、根据选项A的分析,反应至6min时,消耗的H2O2物质的量为2×10-3mol,此时H2O2的物质的量浓度为(10×10-3×0.4-2×10-3)/(10×10-3)mol·L-1=0.2mol·L-1,故C说法错误;D、反应至6min时,H2O2的分解率为2×10-3/(10×10-3×0.4)×100%=50%,故D说法正确。
mol/(L·min)≈3.3×10-2 mol/(L·min),故A说法正确;B、随着反应进行,过氧化氢的浓度降低,化学反应速率降低,即6-10min的平均反应速率v(H2O2)< 3.3×10-2 mol/(L·min),故B说法正确;C、根据选项A的分析,反应至6min时,消耗的H2O2物质的量为2×10-3mol,此时H2O2的物质的量浓度为(10×10-3×0.4-2×10-3)/(10×10-3)mol·L-1=0.2mol·L-1,故C说法错误;D、反应至6min时,H2O2的分解率为2×10-3/(10×10-3×0.4)×100%=50%,故D说法正确。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目