题目内容
在一定体积的密闭容器中,进行如下化学反应:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g),其化学平衡常数K和温度t的关系如下表:
2Fe(s)+3CO2(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选项,多选不得分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(CO)=υ逆(CO2) d.c(CO2)=c(CO)
(4)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率
υ(CO)= ,CO的平衡转化率为: 。
(1)k=c(CO2)3/c(CO)3;(2)放热反应 (3)b、c (4)0.006 mol?L-1?min-1 60%
解析试题分析:(1)可逆反应Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)的化学平衡常数表达式k=c(CO2)3/c(CO)3;(2)由表中数据可知,温度越高化学平衡常数越小,升高温度平衡向逆反应移动,正反应是放热反应;(3)a.无论反应是否达到平衡,该反应的压强均不变 ,故不能说明到达平衡状态,故a错误;
2Fe(s)+3CO2(g)的化学平衡常数表达式k=c(CO2)3/c(CO)3;(2)由表中数据可知,温度越高化学平衡常数越小,升高温度平衡向逆反应移动,正反应是放热反应;(3)a.无论反应是否达到平衡,该反应的压强均不变 ,故不能说明到达平衡状态,故a错误;
b.反应达到平衡状态时,各物质的浓度不变,混合气体中c(CO)不变说明到达平衡状态,故b正确;
c.v (H2)正="v" (H2O)逆不同物质表示的速率之比等于化学计量数之比,说明到达平衡状态,故c正确;d.反应始终按CO与CO2物质的量之比为1:1进行,c(H2)=c(CO)不能说明到达平衡,故d错误;令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+3CO(g)?2 Fe(s)+3CO2(g)
开始(mol):1 1
变化(mol):n 1+n
平衡(mol):1-n 1+n
所以[(1+n)/V]/[(1?n )V]=4,解得n=0.6,所以n(CO2)="0.6mol/10L/10min=0.006" mol?L-1?min-1,CO的平衡转化率为0.6mol 1mol×100%=60%。
考点:化学平衡常数及其计算,反应热,化学平衡移动判断,转化率计算。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为 ,表中y= 。
②T1 T2 ,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与 c(OH-)之比为 。
②该溶液中c(OH-)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
③当向该溶液中加入少量NaOH固体时,c(SO32-) ,c(Na+) 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 。
A.Na2CO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
| A.体系压强保持不变 |
| B.混合气体的密度保持不变 |
| C.CO与H2的浓度之比为1∶2 |
| D.单位时间内,消耗2molH2的同时消耗1mol CH3OH |
(2)已知: CO(g)+
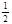 O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+ 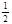 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为 __________
在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。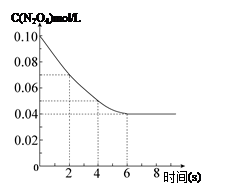
|
(3)在温度为298K时,达到平衡时四氧化二氮的转化率α1等于 。化学平衡常数为 。
(4)若在7s时向该密闭容器中再充入0.10 mol N2O4气体,此时平衡向 方向移动(填“正”或“逆”);再次达平衡时,总计0.20 mol N2O4的转化率为α2,正确的是 ( )
A.α2<α1 B.α2>α1 C.α2=α1 D.无法判断。
(5)下表是不同温度下测定的该反应的化学平衡常数。
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
据此判断该反应正反应是 反应(填“吸热”或“放热”)
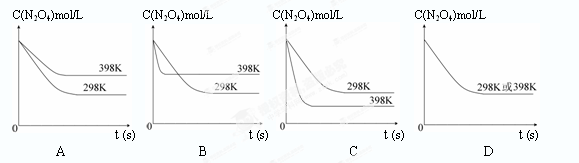
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是 ( )
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式 。
②由上表数据可知该反应为放热反应,理由是 。
③理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)
 CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
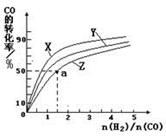
 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: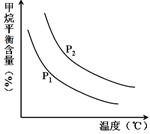
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)
 CO2 (g)+H2(g) 获取。
CO2 (g)+H2(g) 获取。①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度
为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说
明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
 2SO3(g) △H=-198kJ·mol-1
2SO3(g) △H=-198kJ·mol-1
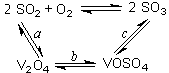
 SO3+ V2O4
SO3+ V2O4 2SO2+O2在550 ℃时的平衡常数K= 。
2SO2+O2在550 ℃时的平衡常数K= 。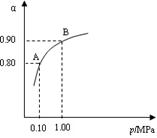
 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。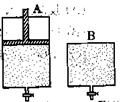
 cC在体积为2L的容器中进行反应。在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的量随时间变化的曲线如下图所示:
cC在体积为2L的容器中进行反应。在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的量随时间变化的曲线如下图所示:
 Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。