题目内容
6.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.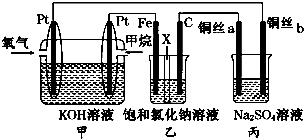
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:CH4-8e-+10 OH-═CO32-+7H2O.
(2)乙池中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体体积为4.48 L.
(4)铜丝a处在开始一段时间的现象为溶液变红;原因是由于2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红(方程式加简要文字说明).
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是bd.
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)室温下,向浓度均为0.1mol/L的MgSO4和CuSO4混合溶液中逐滴加入氨水,先生成X沉淀,生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
(已知:室温时Ksp[Mg[OH]2]=1.8×10-11mol3•L-3,KSP[Cu(OH)2]=2.2×10-20mol3•L-3).
分析 燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应.
(2)电解饱和食盐水生成氢气、氯气和氢氧化钠;
(3)根据串联电池中转移电子数相等计算铁电极上生成氢气的体积;
(4)a为阴极,阴极发生还原反应生成氢气,促进水的电离;
(5)铜的精炼时,粗铜为阳极,纯铜为阴极;
(6)先生成溶度积较小的沉淀.
解答 解:(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10 OH--8e-=CO32-+7H2O.
故答案为:CH4-8e-+10 OH-═CO32-+7H2O;
(2)电解饱和食盐水生成氢气、氯气和氢氧化钠,反应为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=$\frac{2.24L}{22.4L/mol}$×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48,
故答案为:4.48;
(4)a为阴极,发生2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红,
故答案为:溶液变红;由于2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红;
(5)电解精炼铜时利用了电解原理,电能转化为化学能,也有少量转化为热能.电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应.电解时,溶液中的阳离子向阴极移动,在阴极上得电子.粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近.此题应选b、d;
故答案为:bd;
(6)由于Cu(OH)2溶度积较小,则向浓度均为0.1mol/L的MgSO4和CuSO4混合溶液中逐滴加入氨水,先生成Cu(OH)2,反应的离子方程式为Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
点评 本题综合考查电解池和原电池知识,注意把握电化学工作原理,为高考常见题型,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,难度中等.

| A. | 明矾常作为消毒剂 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 高纯度的硅单质广泛用于制作光导纤维 | |
| D. | 钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等 |
| A. | CaCO3 | B. | Al(OH)3 | C. | Mg(OH)2 | D. | MgCO3 |
| A. | 强酸跟强碱反应放出的热量一定是中和热 | |
| B. | 1 mol酸与1 mol碱完全反应放出的热量是中和热 | |
| C. | 在稀溶液中,强酸与强碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 | |
| D. | 表示中和热的离子方程式为H++OH-═H2O△H=-57.3 kJ/mol |
| A. | 金属元素在金属活动顺序表中的位置 | |
| B. | 1mol金属单质在反应中失去电子数目的多少 | |
| C. | 金属元素的最高价氧化物对应的水化物的碱性强弱 | |
| D. | 金属单质与水或酸反应置换出氢气的难易程度 |