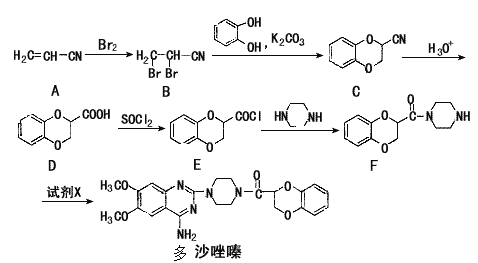
题目内容
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有 。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有____。
CH3OCH3(g)+CO2(g)达到平衡状态的有____。
A.H2和CO2的浓度之比为3:1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
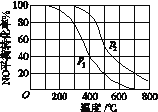
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550℃时,平衡后若充入惰性气体,平衡_______(填“正移”、“逆移”或“不移动”)
②650℃时,反应达平衡后CO2的转化率为__________________(保留2位有效数字)。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数KP=_________P总。
【答案】(1)-246.1 (2分)(2)D (2分)(3)DE (2分)
(4)①> (1分) 正移(1分)②25% (2分) ③0.5(2分)
【解析】
试题分析:(1)已知合成二甲醚的三步反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)△H1=﹣90.7kJmol﹣1
CH3OH(g)△H1=﹣90.7kJmol﹣1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),则△H=2△H1+△H2+△H3=﹣246.1KJ/mol;
CH3OCH3(g)+CO2(g),则△H=2△H1+△H2+△H3=﹣246.1KJ/mol;
(2)A.加入CH3OH相当于增大压强,平衡向逆反应方向进行,产率降低,A错误;B.该反应为放热反应,升高温度平衡逆移,则CH3OCH3产率会降低,B错误;C.该反应正方向为体积增大的方向,所以增大压强平衡左移,不能提高CH3OCH3产率,C错误;D.移出H2O降低生成物浓度,平衡向正反应方向进行,产率增大,D正确;E.使用催化剂不能改变平衡状态,E错误,答案选D。
(3)A.H2和CO2的浓度之比为3:1并不能说明正逆反应速率相等,不能说明反应达到平衡状态,A错误;B.单位时间内断裂3个H-H同时断裂2个C=O可以说明反应达到平衡状态,B错误;C.恒温恒容条件下,气体的质量和容积均不变,则气体的密度保持不变,因此不能根据密度判断反应是否达到平衡状态,C错误;D.恒温恒压条件下气体的质量不变,而气体的物质的量发生变化,则气体的平均摩尔质量保持不变说明反应达到平衡状态,D正确;E.绝热体系中,体系的温度保持不变说明反应达到平衡状态,E错误,答案选DE。
(4)①根据图像可知随着温度的升高,CO的体积分数增加,说明升高温度平衡向正反应方向进行,则该反应△H>0;由于反应在体积可变的恒压密闭容器中进行,当550℃时,若充入惰性气体,容器的容积扩大,使反应混合物的浓度减小,因此正,逆 均减小,由于该反应是气体体积增大的反应,减小压强,化学平衡向气体体积增大的正反应方向移动;
②根据图像可知在650℃时,反应达平衡后CO的体积分数是40%,则CO2的体积分数是60%,假设平衡时总物质的量是1mol,则反应产生CO 0.4mol,其中含有CO2 0.6mo,反应产生0.4molCO消耗CO2的物质的量是0.2mol,因此CO2转化率为0.2mol÷(0.6mol+0.2mol)×100%=25.0%。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数KP=_________P总。
T℃时CO和二氧化碳的体积分数相等,均是50%,用平衡分压代替平衡浓度表示的化学平衡常数KP=![]() 。
。