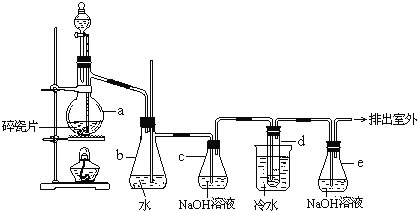
题目内容
【题目】下列说法不正确的是
A.常温下,0.1 mol·L-1CH3COONa溶液的pH=8,则该溶液中 c(CH3COOH)=(10-6-10-8)mol·L—1
B.对于相同浓度的弱酸HX和HY(前者的Ka较大)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值
C.硫酸钡固体在水中存在以下平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),当加入饱和碳酸钠溶液时可以生成BaCO3沉淀
Ba2+(aq)+SO42-(aq),当加入饱和碳酸钠溶液时可以生成BaCO3沉淀
D.常温下,a mol·L-1的CH3COOH溶液与0.01mol·L-1NaOH溶液等体积混合后溶液呈中性,此温度下醋酸的电离平衡常数Ka=![]()
【答案】B
【解析】
A.列出溶液中的电荷守恒式为:![]() ,溶液中的物料守恒式为:
,溶液中的物料守恒式为:![]() ,两式联立可得:
,两式联立可得:![]() ,又因为溶液在常温下pH=8,所以有
,又因为溶液在常温下pH=8,所以有![]() ,A项正确;
,A项正确;
B.由于![]() ,HX酸性更强,所以HX溶液在稀释过程中pH变化更明显,B项错误;
,HX酸性更强,所以HX溶液在稀释过程中pH变化更明显,B项错误;
C.硫酸钡向碳酸钡的转化方程式为:![]() ,当向硫酸钡中加饱和碳酸钠溶液时,溶液中的碳酸根浓度很高,可以让上述转化反应正向进行,生成BaCO3沉淀,C项正确;
,当向硫酸钡中加饱和碳酸钠溶液时,溶液中的碳酸根浓度很高,可以让上述转化反应正向进行,生成BaCO3沉淀,C项正确;
D.常温下,两种溶液混合后,溶液呈中性,即:![]() =10-7mol/L;列出溶液的电荷守恒式:
=10-7mol/L;列出溶液的电荷守恒式:![]() ,所以有:
,所以有:![]() ;此外,溶液中还有下列等式成立:
;此外,溶液中还有下列等式成立:![]() ,所以
,所以![]() ;醋酸的电离平衡常数即为:
;醋酸的电离平衡常数即为: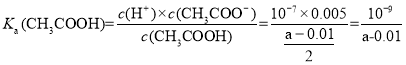 ,D项正确;
,D项正确;
答案选B。

【题目】下表为元素周期表的一部分,请参照元素![]() 在表中的位置,用 化 学 用 语回答下列问题:
在表中的位置,用 化 学 用 语回答下列问题:
族 周期 | IA | 0 | ||||||
1 |
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 |
|
|
| |||||
3 |
|
|
|
| ||||
![]() 的原子结构示意图为_________。
的原子结构示意图为_________。
![]() 的气态氢化物分子的结构式为_____________。
的气态氢化物分子的结构式为_____________。
![]() 、
、![]() 的最高价含氧酸的酸性由强到弱的顺序是________________。
的最高价含氧酸的酸性由强到弱的顺序是________________。![]() 填化学式
填化学式![]()
![]() 、
、![]() 元素的金属性强弱依次为___________。
元素的金属性强弱依次为___________。![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]()
![]() 、
、![]() 、
、![]() 的形成的简单离子半径依次_______。
的形成的简单离子半径依次_______。![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]()
![]() 、
、![]() 元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。