题目内容
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
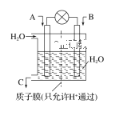
(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为________极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为________________________________________________________________________。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为________________________________________________________________________。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。
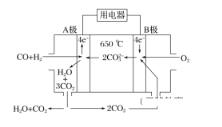
①电池总反应为________________________________________________________________________。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准状况下体积为______ L。电解后溶液体积为2 L,溶液的pH约为________。
【答案】正SO2+2H2O-2e-=SO42-+4H+O2+4e-+4H+═2H2OCO+H2+O2=3CO2+H2O1.121
【解析】
(1)①燃料电池中,通入氧化剂的电极是正极、通入还原剂的电极是负极,该反应中C元素化合价由+2价变为-2价、H元素化合价由0价变为+1价,所以CO是氧化剂,则通入CO的电极为正极,电极反应式为CO+4e-+4H+=CH3OH;综上所述,本题答案是:正。
②若A为SO2,B为O2,C为H2SO4,二氧化硫和氧气、水反应生成硫酸,负极上二氧化硫失电子和水反应生成硫酸根离子和氢离子,电极反应式为SO2+2H2O-2e-=SO42-+4H+;综上所述,本题答案是:SO2+2H2O-2e-=SO42-+4H+。
③若A为NO2,B为O2,C为HNO3,二氧化氮、氧气和水反应生成硝酸,正极发生还原反应,氧气得电子生成水,电极反应式为O2+4e-+4H+═2H2O;综上所述,本题答案是:O2+4e-+4H+═2H2O。
(2)①该燃料电池中,负极的气体按物质的量之比为1:1参与反应,则负极上一氧化碳、氢气失电子和正极氧气得电子两极反应生成二氧化碳和水,电极总反应为CO+H2+O2=3CO2+H2O;综上所述,本题答案是:CO+H2+O2=3CO2+H2O。
②电解硝酸银溶液阴极反应为Ag+e-=Ag,阳极反应为4OH--4e-=2H2O+O2↑,阴极生成21.6g银,其物质的量为21.6g÷108g/mol=0.2mol,转移电子0.2mol,根据电子守恒,阳极产生氧气0.05mol,标准状况下体积为0.05mol×22.4L/mol=1.12L,电解后溶液生成H+为0.2mol,体积为2L,H+的物质的量浓度为0.1mol/L,溶液的PH=-lg0.1=1;综上所述,本题答案是:1.12,1。

【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不能满足图示转化关系的是

甲 | 乙 | 丙 | 戊 | |
A | Cu | FeCl3溶液 | CuCl2溶液 | Fe |
B | H2O | Fe | H2 | O2 |
C | Al | NaOH溶液 | H2 | Al2O3 |
D | CH3CH2OH | O2 | CH3CHO | H2 |
A. A B. B C. C D. D