题目内容
【题目】下列生产、生活等实际应用,不能用勒沙特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.实验室中常用排饱和食盐水的方法收集Cl2
C.工业合成氨时选择高温能极大加快反应速率
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
【答案】C
【解析】
A、啤酒中存在二氧化碳的溶解平衡,开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强减小,二氧化碳逸出,能用勒沙特列原理解释,故A不选;
B、存在氯气和水反应生成盐酸和次氯酸的平衡,饱和食盐水中氯离子浓度较大,使得平衡逆向移动,减小了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用勒沙特列原理解释,故B不选;
C、工业合成氨的反应为放热反应,高温不利于提高氨气的产率,主要是选择铁做催化剂在高温下,催化剂的活性较高,不能用勒沙特列原理解释,故C选;
D、存在平衡2SO2+O2 ![]() 2SO3,使用过量的空气,可以增大氧气的浓度,可以使化学平衡正向移动,提高SO2的利用率,能用勒沙特列原理解释,故D不选;
2SO3,使用过量的空气,可以增大氧气的浓度,可以使化学平衡正向移动,提高SO2的利用率,能用勒沙特列原理解释,故D不选;
故选C。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
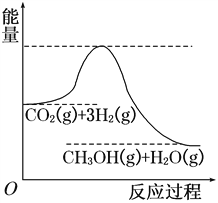
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
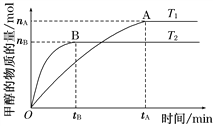
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。



