题目内容
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
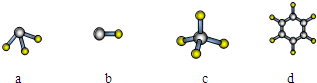
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 33 | 164 |
(本题共8分)
(1)4 (1分) ;3 (1分);c d (2分) (2)AB (2分)
(3) (1分) ; CH4 (1分)
解析:

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
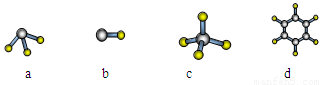
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33 |
164 |