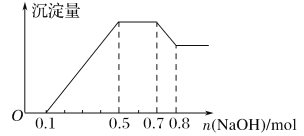
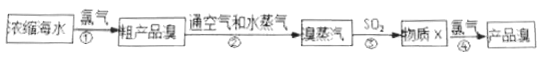
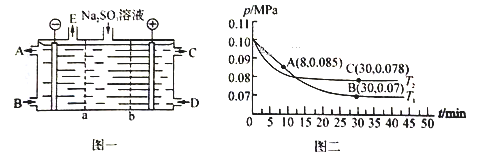
题目内容
【题目】对于反应COCl2(g) ![]() CO(g)+Cl2(g) ΔH>0。改变下列条件,能加快反应速率,且CO的物质的量分数增大的是
CO(g)+Cl2(g) ΔH>0。改变下列条件,能加快反应速率,且CO的物质的量分数增大的是
A. 恒容下通入He B. 恒容下增大COCl2的浓度
C. 加催化剂 D. 升温
【答案】D
【解析】分析:根据反应方程式可知,要加快反应速率且CO的物质的量分数增大,可以采用升高温度的措施。
详解:A. 恒容条件下通入He,反应物浓度不变,则反应速率不变,平衡不移动,CO的物质的量分数不变,故A错误;
B. 恒容条件下增大COCl2的浓度,反应速率加快,但CO的物质的量分数减小,故B错误;
C. 加入催化剂,可以加快反应速率,但平衡不移动,CO的物质的量分数不变,故C错误;
D.升高温度,可以加快反应速率,因该反应为吸热反应,所以平衡正向移动,CO的物质的量分数增大,故D正确;答案选D。

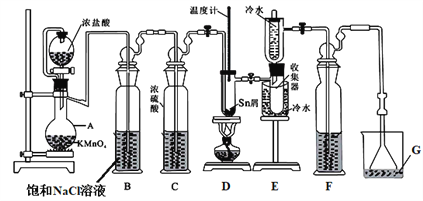
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______________。
(2)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是_____________________________________。
(3)设置试剂F的目的是_______________。
(4)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用c mol·L-1 碘单质标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量______(用含c、m、V的代数式表示)。
(5)某实验小组甲欲证明由A装置产生的气体中确实含有HCl,设计了如下实验装置。
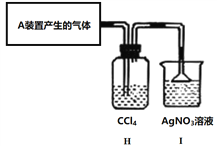
乙小组认为,不能确定进入I装置的气体只有一种。经过充分讨论,乙小组认为可以在不改动装置的前提下,仅替换一种试剂,即可完成论证。请给出改动方案:_____________。