��Ŀ����
17��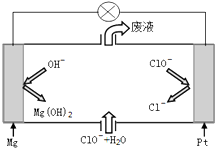 ��������Ҫ���Եز�����ʣ���������ơ�����þ����̬���ڣ�����������������Ҫ��Ӧ�ã�
��������Ҫ���Եز�����ʣ���������ơ�����þ����̬���ڣ�����������������Ҫ��Ӧ�ã���1����֪ij�¶��µ��ĸ���Ӧ��
��Na2SO4��s���TNa2S��s��+2O2��g����H1
��C��s��+O2��g���TCO2��g����H2=-394.0kJ/mol
��2C��s��+O2��g���T2CO��g����H3=-221.5kJ/mol
��Na2SO4��s��+4C��s���TNa2S��s��+4CO��g����H4=+569.0kJ/mol���ش��������⣺
��1����Ӧ���С�H1=+1012.0kJ/mol����Ӧ���з�Ӧ�Na2SO4�����������������Na2S��O2�����������ͣ���ߡ��͡���
��2����ҵ�����÷�Ӧ���Ʊ�Na2Sʱ���������ȡ�������ִ�ʩ��
a�����������̿��Ŀ���DZ�֤Na2SO4�õ���ַ�Ӧ�����Na2SO4��������
b��ͨ�������Ŀ�����Ŀ����C��CO������е�������Ӧ���ų�������ά�ַ�Ӧ�����������
��2������ʱ����CO��ԭMgSO4���Ʊ��ߴ���MgO��
��1��750��ʱ����÷�Ӧ��������к������ʵ���SO2��SO3��д���������·�Ӧ�Ļ�ѧ����ʽ2MgSO4+CO$\frac{\underline{\;750��\;}}{\;}$2MgO+SO2+SO3+CO2
��2��Ŀǰ�Ѿ��Ƴɡ�þ--�������Ρ�ȼ�ϵ�أ��乤��ԭ������ͼ��ʾ���õ�ط�Ӧ�Ļ�ѧ���̳�ʽΪMg+ClO-+H2O=Cl-+Mg��OH��2
��3��PbSO4������ˮ�����ܽ��ڴ�����Һ������Ϊ����ԭ�������п��ܵ��Ǣ٢ۢݣ�����ţ�
�ٴ���Ǧ������ˮ
�ڴ���Ǧ����ǿ�����
�۴���Ǧ�����������
�ܴ��������ᣬ���Դ�������PbSO4��Ӧ
�ݴ���Ǧ��ˮ���γɵ���ƽ��ʱ��c��Pb2+��С��PbSO4�γ��ܽ�ƽ��ʱ��c��Pb2+��
���� ��1����1�������Ȼ�ѧ����ʽ��˹���ɼ����H��
��2���ڷ�ӦNa2SO4��s��+4C��s���TNa2S��s��+4CO��g���м��������̿����֤Na2SO4�õ���ַ�Ӧ�����Na2SO4�������ʣ�ͨ�������Ŀ�����C��CO������е�������Ӧ���ų�������ά�ַ�Ӧ�������������
��2����1��������Ŀ��Ϣд����������������غ���ƽ��
��2����ͼ��֪þ-�������Ρ�ȼ�ϵ����Mg��ClO-��H2O��Ӧ����Cl-��Mg��OH��2��
��3������Ǧ��ˮ��Һ������ܽ�ƽ�⣬�������ʱ����������Ӻ�Ǧ��������������ʴ���Ǧ���ٽ�����Ǧ�ܽ⣮
��� �⣺��1����1����֪ij�¶��µ��ĸ���Ӧ��
��Na2SO4��s���TNa2S��s��+2O2��g����H1
��C��s��+O2��g���TCO2��g����H2=-394.0kJ/mol
��2C��s��+O2��g���T2CO��g����H3=-221.5kJ/mol
��Na2SO4��s��+4C��s���TNa2S��s��+4CO��g����H4=+569.0kJ/mol��
�ݸ�˹���ɣ���-�ۡ�2��Na2SO4��s���TNa2S��s��+2O2��g����H1=569.0kJ/mol+221.5kJ/mol��2=1012.0kJ/mol����Ӧ����˵����Ӧ��������������������������
�ʴ�Ϊ��+1012.0���ͣ�
��2���ڷ�ӦNa2SO4��s��+4C��s���TNa2S��s��+4CO��g���м��������̿����֤Na2SO4�õ���ַ�Ӧ�����Na2SO4�������ʣ�ͨ�������Ŀ�����C��CO������е�������Ӧ���ų�������ά�ַ�Ӧ�������������
�ʴ�Ϊ����֤Na2SO4�õ���ַ�Ӧ�����Na2SO4�������ʣ�C��CO������е�������Ӧ���ų�������ά�ַ�Ӧ�������������
��2����1����CO��ԭMgSO4�ɵõ�MgO��CO2��SO2��SO3������ʽΪ2MgSO4+CO$\frac{\underline{\;750��\;}}{\;}$2MgO+SO2+SO3+CO2���ʴ�Ϊ��2MgSO4+CO$\frac{\underline{\;750��\;}}{\;}$2MgO+SO2+SO3+CO2��
��2����ͼ��֪þ-�������Ρ�ȼ�ϵ����Mg��ClO-��H2O��Ӧ����Cl-��Mg��OH��2���õ�ط�Ӧ���ܷ�Ӧ����ʽΪMg+ClO-+H2O=Cl-+Mg��OH��2�������缫��Ӧ��ClO-���ӵõ����ӷ�����ԭ��Ӧ���缫��ӦΪ��ClO-+2e-+H2O=Cl-+2OH-�������缫��Ӧ��Mgʧȥ���ӷ���������Ӧ���缫��ӦΪ��Mg-2e-+2OH-=Mg��OH��2��
�ʴ�Ϊ��Mg+ClO-+H2O=Cl-+Mg��OH��2��
��3������Ǧ��ˮ��Һ������ܽ�ƽ�⣬�������ʱ����������Ӻ�Ǧ��������������ʴ���Ǧ���ٽ�����Ǧ�ܽ⣬
�ʴ�Ϊ���٢ۢݣ�
���� ���⿼���֪ʶ��϶࣬�ȿ����˵绯ѧ�ֿ����˷�Ӧ�ȵ����⣬��ѧ���ۺ�����֪ʶ������һ����Ҫ���ر��Ǹ���ͼ����Ϣд�缫��Ӧ��Ҫ��ѧ���нϺô�ͼ�л�ȡ��Ϣ��������������Ŀ�ѶȽϴ�

 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�2H2S��g��+3O2��g���T2SO2��g��+2H2O��l����H1=-Q1kJ/mol
2H2S��g��+O2��g���T2S ��s��+2H2O��l����H 2=-Q2 kJ/mol
2H2S��g��+O2��g���T2S ��s��+2H2O��g����H 3=-Q3 kJ/mol
����֪��H2S��ȫȼ������SO2������ȫȼ������S��
�жϡ�H1����H2����H3���߹�ϵ��ȷ���ǣ�������
| A�� | ��H1����H2����H3 | B�� | ��H1����H3����H2 | C�� | ��H3����H2����H1 | D�� | ��H2����H1����H3 |
| A�� | ��״����22.4L Cl2������NaOH��Һ��Ӧ����NaCl��NaClO��ת�Ƶ�����ΪNa | |
| B�� | 16g�����к��еķǼ��Թ��ۼ�����Ϊ4Na | |
| C�� | һ�������SO2����ˮ���γ�pHΪ2��ˮ��Һ������H+����ĿΪ0.01Na | |
| D�� | 1.8gD2O�к��е�������Ϊ2Na |
| ���� | Al | Al2O3 | Fe | Fe2O3 |
| �۵�/�� | 660 | 2054 | 1535 | 1565 |
| �е�/�� | 2467 | 2980 | 2750 | ------ |
��1�����ȷ�Ӧ��������ԭ��Ӧ���ڷ�Ӧ�н��������������������ԭ������
��2��ijͬѧ�������������Ʋ⣬���ȷ�Ӧ���õ�����������Ӧ�������������ֽ����������һ����ʵ�鷽��֤�����������к��н���������ʵ�������õ��Լ�ΪNaOH��Һ���ɹ۲쵽��ʵ������Ϊ������ɫ����ų���
��3��ʵ�������ܽ������������Լ�����õ���B������ţ���
A��Ũ���ᡡB��ϡ���ᡡC��ϡ���ᡡD��NaOH��Һ��

 A��B��C��D��E����ѧ�������������ʣ���ת����ϵ��ͼ��ʾ������ijЩ���ʿ�������ȥ����֪D�ǵ��ʣ�C��E�ǻ����
A��B��C��D��E����ѧ�������������ʣ���ת����ϵ��ͼ��ʾ������ijЩ���ʿ�������ȥ����֪D�ǵ��ʣ�C��E�ǻ���� ��
��